VPS4 (Kr.16q22.1)
VPS4:n osuus exosomin abskissiossa , kun ESCRT-II on saanut valmiiksi pakattua exosomaalisen pussin. Abscissio vaihe, josta voidaan sitten hajoitaa rakenteelliset ESCRT- tekijät hyödynnyskiertoon, kuten normaalissa mitoosi-sytokineesi transitiossamutta virukset, jotka hyödyntävät tätä sytokinetiikkaa, voivat pakata ESCRT- tekijöitä ja tätäkin VSP4.ää virioniin mukaan
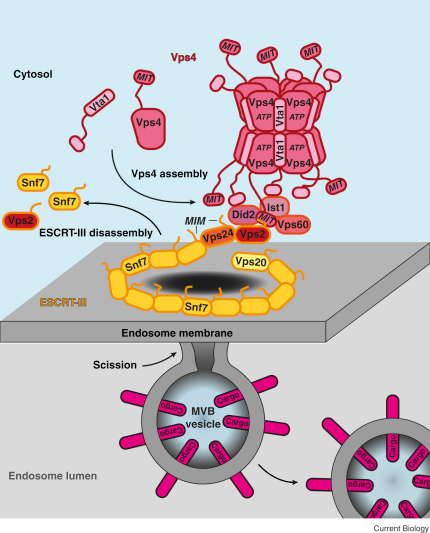
Löysin kaavakuvan VSP-n asemasta ESCRT-III taphtumien jatkossa.
Taphtuu VSP4 monomeerien koostuminen VSP-oligomeeriksi, interaktio ESCRT-tekijöiden kanssa ja ESCRT-II disassembly, tekijöiden erkaneminen. ja exosomin abskissio, erotus. Abskissiotapahtumassa ESCRT-III:n puolelta CHMP4B ja VPS4 puolelta VPS4A tekevät interaktion, joka ajallisesti ja tilavuudellisesti korreloi abskissioon joka siinä samassa on tapahtunut.
https://openi.nlm.nih.gov/detailedresult.php?img=PMC3314914_gr3&req=4
Human VPS4 gene
https://www.ncbi.nlm.nih.gov/gene/27183
- Preferred Names
- vacuolar protein sorting-associated protein 4A
- Names
- SKD1-homolog
- hVPS4
- vacuolar protein sorting factor 4A
- vacuolar sorting protein
-
- EC 3.6.4.6
- Also known as
- SKD1; SKD2; VPS4; SKD1A; VPS4-1
RAKENNE ( peptidisekvenssi)
https://www.ncbi.nlm.nih.gov/protein/NP_037377.1
Huom. AMSH (JAMM, DUB deubikitinaasi ) (Associated molecule with SH3 domain of STAM)
on ESCRT-II:een assosioitunut entsyymi ja se kilpailee VPS4:n kanssa sitoutumisesta CHMP1A:n ja CHMPiB:n C-terminaalisiin alueihin
http://www.jbc.org/content/281/32/23083
J Biol Chem. 2006 Aug 11;281(32):23083-91. Epub 2006 Jun 7.
Interaction of AMSH with ESCRT-III and deubiquitination of endosomal cargo.
Agromayor M1, Martin-Serrano J. Abstract
The
"class E" vacuolar protein sorting (VPS) pathway mediates sorting of
ubiquitinated cargo into the forming vesicles of the multivesicular
bodies (MVB), and it is essential for down-regulation of signaling by
growth factors and budding of enveloped viruses such as Ebola and HIV-1. Work in yeast has identified DOA4 as a gene that is recruited by the class E machinery to remove ubiquitin
from the endosomal cargo before it is incorporated into MVB vesicles,
but the identity of the mammalian counterpart is unclear. Here we report
the interaction of AMSH (associated molecule with the SH3 domain of
STAM), an endosomal deubiquitinating enzyme, with the endosomal sorting
complex required for transport (ESCRT-III) subunits CHMP1A, CHMP1B,
CHMP2A, and CHMP3. We also show that a catalytically inactive AMSH
inhibits retroviral budding in a dominant-negative manner and induces
the accumulation of ubiquitinated forms of an endosomal cargo, namely
murine leukemia virus Gag. Finally, VPS4 and AMSH compete for binding to
the C-terminal regions of CHMP1A and CHMP1B, revealing a coordinated
interaction with ESCRT-III. Taken together, these results are consistent
with a role of AMSH in the deubiquitination of the endosomal cargo
preceding lysosomal degradation.
- PMID:
- 16760479
- DOI:
- 10.1074/jbc.M513803200

Inga kommentarer:
Skicka en kommentar