TRIM29 (Kr.11q23.3) ATDC, FLJ36085 (C_UC)
TRIM29 geeni on rakenteeltaan luokittelemattomien joukossa.Syytä on katsoa erikoista rakenneta tuosta linkistä eräistä isoformeista. Vuonna 2008 mainittiin,että se lasketaan TRIM-proteiiniperheeseen- siinä tosin ei ole RING- motiivia ja se on luokittelemattomassa ryhmssä (unclassified) , mutta siinä on paljon erikoisia kohtia. Siinä on multippeleita sinkkisormimotiiveja ja leusiini Zipper-motiivi. Oletetaan sen muodostavan homo-ja heterodimeerejä, jotka osallistuvat nukleiinihappojen sitomiseen Se saattaa toimia transkriptionaalisena säätelytekijänä, sanottiin, ja sillä on osutta syövänsynnyssä ja/tai erilaistumisessa. On katsottu sen voivan vähentää säteilyherkkyyttä, koska siihen liittyy Ataxia Teleangiectasia-fenotyyppi (A-T), mistä toinen nimikin TRIM29:lle on lyhennyksenä ATCD ( (Ataxia-Teleangiectasia of group D Complement Gene; interacts with a protein kinase C substrate and inhibitor). Geeniä ilmenee ruokatorvessa ja ihossa sekä vähän myös neljässä muussa kudoksessa.
Viime vuosina on tullut paljon artikkeleita TRIM29:stä onkologian alalta.
Esimerkkejä on paljon sen osallistumisesta erilaisiin syöpiin. . PubMed haku (84 artikkelia). Asetan linkin josta niitä löytää. Mutta yhden tiviistelmän suomennan, joka ilmeisesti kuvaa TRIM29 geenin varsinaista tärkeä fysiologista funktiota DNA korjausjärjestelmän osana.
- Summary The protein encoded by this gene belongs to the TRIM protein family. It has multiple zinc finger motifs and a leucine zipper motif. It has been proposed to form homo- or heterodimers which are involved in nucleic acid binding. Thus, it may act as a transcriptional regulatory factor involved in carcinogenesis and/or differentiation. It may also function in the suppression of radiosensitivity since it is associated with ataxia telangiectasia phenotype. [provided by RefSeq, Jul 2008] Expression
- Biased expression in esophagus (RPKM 274.4), skin (RPKM 264.0) and 4 other tissues See more
Erään isoformin rakenne: Tässä isoformissa 1 on aminohappoja 588
ja seuraavia rakentellisia seikkoja herättää mielenkiintoa:
Useita
forsforylaatiokohtia: Fosfoseriinejä ( aminohapoissa 21,28,58,104
.489); fosfotyrosiinia (aminohapossa 106); fosfothreoniinia
aminohapossa 476). Aminohappojakso 220..260 on Bbox Zn Finger; (Zn2+
sitovia kohtia 225,228,247,252)-Aminohappojakso 273..355 OmpH (Outer
membrane protein) .
IsoformissaX3
mainitaan aminohappojakso 1-107: Apolipoprotein AI/A4/E domeeni.
Isoformissa X2
mainitaan aminohapoissa 20-99 Spectrin repeat domain SPEC. (
spektriini osallistuu sytoskeletonrakenteeseen) 3 helixkimppua,
joista toinen on proliinien keskeyttämä).
https://www.ncbi.nlm.nih.gov/protein/NP_036233.2Mielenkiintoinen artikkeli: TRIM29 ja DNA DSB korjaus
-
TRIM29 regulates the assembly of DNA repair proteins into damaged chromatin. Masuda Y, et al. Nat Commun, 2015 Jun 22. PMID 26095369
-
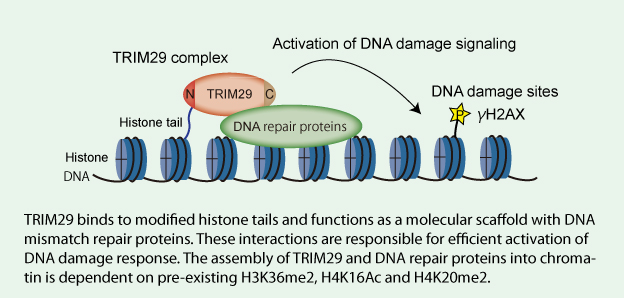
(Suomennosta) Vaikka DNA:n molempien säikeiden katkon (DSB) korjausta välittää lukuisat proteiinit, joita katkeamakohtiin kertyy, ei ole kuitenkaan aivan täysin pystytty ratkaisemaan, miten DNA:n korjausproteiniit kokoontuvat vaurioituneeseen kromatiiniinTässä artikkelin työssä tutkijat osoittavat, että TRIMperheen jäsen TRIM29 on histonia sitova proteiini, joka vastaa DNA:n molempien säikeiden katkeaman vasteesta.Tutkijat havaitsivat, että TRIM29 tekee interaktion BRCA1-assosioituneen tarkistavan kompleksin, kohesionin, DNA-Pkc entsyymien ja TIP60 kompleksin komponenttien kanssa. (BRCA1 on RNF53, RING finger protein) (BASC= BRCA1 associated surveillance complex)TRIM29 sisältävän kompleksin dynamiikka H2Ax nukleosomissa koordinoituu histonimodifikaatioilla. TRIM29 sitoutuu nukleosomien modifioituneitten histonien H3 ja H4 päätyihin. TRIM28:n sitoutuminen on välttämätön H2AX:n fosforyloimiseksi ja solun elinkykyisyydelle jonisoidun säteilyn altistuksessa. Tulokset viittaavat siihen, että TRIM29 toimii rakenteellisena alustana koottaessa DNA:n korjausproteiineja kromatiinille tehokkaan DDR-aktivaation tapahduttua.
-
Although DNA double-strand break (DSB) repair is mediated by numerous proteins accumulated at DSB sites, how DNA repair proteins are assembled into damaged chromatin has not been fully elucidated. Here we show that a member of the tripartite motif protein family, TRIM29, is a histone-binding protein responsible for DNA damage response (DDR). We found that TRIM29 interacts with BASC (BRCA1-associated surveillance complex), cohesion, DNA-PKcs and components of TIP60 complex. The dynamics of the TRIM29-containing complex on H2AX nucleosomes is coordinated by a cross-talk between histone modifications. TRIM29 binds to modified histone H3 and H4 tails in the context of nucleosomes. Furthermore, chromatin binding of TRIM29 is required for the phosphorylation of H2AX and cell viability in response to ionizing radiation. Our results suggest that TRIM29 functions as a scaffold protein to assemble DNA repair proteins into chromatin followed by efficient activation of DDR.
-
KTS: KUVAT:
-

Inga kommentarer:
Skicka en kommentar