LÄHDE: Olson Fredrik. Alterations of Mucin O-glycosylation in response to intestinal infection. Importance of specific glycosyltransferases. Göteborg (2002) ISBN 91-628.5413-5
https://gupea.ub.gu.se/handle/2077/15687?locale=sv
Samalta tiedemieheltä löytyy 33 artikkelia netistä.
Esim vuodelta 2005 myös musiineja käsitelevä työ.
Suomennosta tiivistelmästä. Abstrakti 2002
Musiinit ovat suuria glykoproteiineja (gp) ja ne
muodostavat suurimman osan epiteelien pintoja peittävästä
limakalvolimasta (mucus). Musiineille on tyypillistä tiheä ja
heterogeeninen O-glykosylaatio, mikä on tärkeä seikka niiden
kemiallisissa ja fysiologisissa ominaisuuksissa. Mucus-kerros
muodostaa selektiivisen fysikaalisen esteen suojaten epiteeliä niin
fysikaalisilta kuin kemiallisilta rasitteilta. Kun mukoottinen
rakenne on heterogeenisesti glykosyloitunutta, se saattanee
tehokkaammin vuorovaikuttaa epiteeleissä asustaviin mikrobeihin.
Sen rakenteet toimivat mikrobien adhesiinien kohdemolekyyleinä.
Tässä auttanee lisätietämys musiinien O-glykosylaatiosta ja
musiinin biosynteesistä.
Tiedemies tutki koe-eläimen ohuen suolen
musiinien O-glykosyloitumista, lähinnä musiini-2 kyseessä ( muc-2)
ja sekin tilanteessa, kun suolistoloinen Nippostrongylus brasiliensis
oli infektoinut suolta. Infektion eri vaiheista otettiin
limanäytteet. Eritteet käsiteltiin seuraavasti: proteiinirunko
erotettiin ja oligosakkaridit jaettiin neutraaleihin,
sialyloituneihin ja sulfatoituneihin lajeihin. Oligosakkaridien
rakenteet analysoitiin käyttäen
kaasukromatografia-massaspektrometriamenetelmää, nukleaarista
magneettista resonanssia (NMR) ja pH-anionivaihtokromatografiaa.. Kun
vertailtiin terveen ja infektoitunean koe-eläimen oligosakkarideja,
havaittiin ohimeneviä infection aikaisia spesifisiä muuntumisia.
Tämä viittaisi musiinien O-glykosylaation dynaamiseen säätymiseen.
Mitä nämä muutokset olivat ?
1) N-asetyylineuramiinihapon (NeuAc) määrän
suhde N-glykolyylineuramiinihappoon
(NeuGc) kohosi
2) Veriryhmä A:lle tyypillisiä terminaalisia epitooppeja ilmeni
3) Ilmeni myös veriryhmä Sda/Cad tyyppisiä terminaalisia
epitooppeja.
Entsyymit, jotka vastasivat kahdesta ensimmäisestä
muutoksesta, olivat
(1) CMP-NeuAc hydroksylaasi ja
(2) veriryhmä A GalNac-transferaasi.
Koe-eläimen ( rotan) veriryhmän A glykosyylitransferaasi kloonattiin
ja sekvensoitiin genomitasolla ja cDNA-tasolla. Geeni osoittautui
olevan kromosomiasemassa 3q11-12, kun tutkittiin FISH-menetelmällä
( fluorescence in-situ hybridisation) ja RH-kartoituksella
(radiation hybrid mapping). cDNA kloonauksessa identifioitiin kaksi
95 %;sti ssamanlaista sekvenssiä, jotka molemmat koodasivat
aktiiveja transferaaseja. PCR-tutkimuksin osoitettiin ne
alleeleiksi. Suuri ero alleelien kesken osoittaisi evolutionaalista
painetta tämän geenin korkean mutaatiofrekvenssin eduksi.
Musiinin glykosylaatiossa on ollut vaikea määrätä osoitetta
O-spesifisten glykaanikohtien glykosylaatioille, koska sellaisia
kohtia on runsaasti musiinissa. Analyysien helpottamiseksi tehtiin
seuraavaa: Konstruoitiin lyhyt rekombinoitu reportteriproteiini, jonka
perusrakenteessa oli MUC1 ja sen glykosyloidun domaanin sekvenssi
oli oli 8 kappaletta O-glykaanikohtia.
Kun tätä proteiinia tuotettiin eräissä soluissa (CHO K1), niin
oligosakkaridi päätuotteet osoittautuivat olevan kerran tai
kahdesti sialyloituja. Core 1- glykaaneja.
(Menetelmät olivat LC-ESI-MS ja LC-ESI-MS/MS). Kun sekvensoitiin
N-terminaalinen peptidi, osoittautui, että kaikki yksittäiset
O-glykaanikohdat olivat glykosyloituneina 75-95 %:sti.
O-glykaanikohtien laajempaa osllistumista glykosylaatioon voisi
lisätä samanaikainen polypeptidin GalNac-T4 ilmenemää. Nimittäin
in vitro on osoitettu että GalNAc-T4 lisää GalNAc-
molekyyliä polypeptidien runkoon MUC1 polypeptideissä. Nämä
kokeet viittaavat siihen, että GalNACc-T4 omaa in vivo
aktiviteettia.
(GalNAc-T on UDP-GalNAc:polypeptidi
N-acetylgalactosaminyltransferase)
GalNAc on N-acetylgalactosamine
NeuAc on N-acetylneuraminic acid
NeuGc on N-glycolyneuraminic acid ( Tätä ei ole ihmisellä!
)
Kirjassa esitettyjä asioita:
Kirjassa esitetään tarkasti O-glykosyloitujen
musiinien perusrakenteet,
Musiinien (MUC) alaryhmät ovat
a) membraaniin kiinnittyvät musiinit,
b) geeliä
muodostavat musiinit ja
c) monomeeriset musiinit
Ihmisestä on kuvattu neljä geeliä muodostava musiinia (MUC2,
MUC5AC, MUC5B, MUC6). Niiden geenit on koodattu ja sekventoitu.
Niiden kromosomi on 11p15.5. Domaanien lähellä on hyvin
cysteiinipitoisia domaaneja molemmissa päissä.
Ihmisen MUC2
tutkimuksia on tehty endoplasmisen retikulumin (ER) alueelta, missä
tapahtuu C-terminaalinen dimerisaatio ja Golgin laitteesta
trans-Golgin alueelta (jossa tapahtuu tärkeä multimerisaatio) tai
myöhemmästä sekretorisesta vaiheesta.

Musiinien
multimerisaatiokyky on pohjana tärkeän limakalvoja suojaavan
eriteverkoston luomisessa.
Näitä eri musiinikomponentteja (b) on havaittavissa eri
tyyppisinä kehon eri limakalvoilla.
Ihmisen musiineista tiedetään, että
ohutsuolessa on tyyppiä MUC2,
( hieman myös MUC6).
paksussuolessa on samoin näitä edellisiä.
Mahalaukussa on MUC5AC, MUC6.
Hengitysteissä on MUC5AC, MUC5B (ja vähän MUC2).
Sylkirauhasissa on MUC5B
Reproduktiivilla limakalvoilla esiintyy MUC5B, (MUC2), (MUC5AC),
(MUC6).
Sappitiehyessä esiintyy MUC5B, (MUC6).
Membraaneihin sitoutuneita musiineja (a) on
havaittu ihmisellä ainakin seuraavia tyyppejä:
MUC1, MUC3A, MUC3B, MUC12, MUC17,
Näitten
geeniryväs on kromosomi 7q22.
Erittäin isorakenteinen musiini on MUC4. Sillä
on vWF-motiivin kaltaista yhteisrakennetta geeliä muodostavien (b)
musiinien kanssa ja se saattaa toimia niiden musiinien siltana.
Kalvoon sitoutuvat musiinit sijaitsvat soluissa apikaalisesti. Nämä
musiinit voivat pilkkoutua ja ulompi osa erittyy, irtoaa toimien
antiadheesivisesti fysikaalisena esteenä solu-solu- kontakteille.
Mutta lektiinien kanssa ne voivat toisaalta toimia
adheesiotekijänäkin.( Bakteerin fago-opsonisaatio)
Näitten kalvoon kiinnittyvien (a)
musiinityyppien sijoittautumisesta tiedetään seuraavaa
MUC1: rintarauhasessa, sappirakossa, kohdunsuussa, haimassa,
vertamuodostavissa
soluissa; ( ilmateissä)
MUC3A ohutsuolessa, sappirakossa,( paksusuolessa)
MUC3B ohutsuolessa, paksusuolessa
MUC4 ohutsuolessa, paksusuolessa, mahalaukussa, ilmateissä,
sylkirauhasissa, kohdunsuussa, silmän limakalvolla
MUC12 paksusuolessa, ( haimassa)
MUC13 paksusuolessa, ilmateissä,( ohutsuolessa),
(mahalaukussa),( munuaisessa)
MUC17 ohutsuolessa, paksusuolessa, ( mahalaukussa).
Miten musiini muodostuu ?
Solun sytoplasmassa muodostuu erilaisia monosakkarideja kuten
galaktoosia, fukoosia, N-asetylglukosamineja,
N-asetylgalaktosamineja, fukoosia, neuramiinihappoa . Kun näitä
tuotetaan, ne ovat monosakkaridinukleotidimuodoissaan (UDP-GalNAc,
UDP-Gal, UDP-GlcNAc, GDP-Fuc, CMP-NeuAc). Käyttöenergia tuleviin
oligosakkaridin liittämisiin saadaan näistä korkea-energisistä
sokerinukleotidisidoksista.
Luonnolliseti tarvitaan runsaasti entsyymejä.
Biosynteesissä
erotetaankin sitten neljä varsinaista osaa.
Apo-proteiini (apoMUC, prekursorimolekyyli), johon
näitä glykosyloitumisia suoritetaan, omaa runsaasti seriiniä(S),
threoniinia (T) ja proliinia (P) ja muutamia muitakin aminohappoja. Niiden
aminohappojen järjestys ei ole mitenkään erityisen täsmällinen,
vaan tärkeämpi seikka on toistuvien jaksojenmäärä, (Tandem
repeat), sillä glykosyloitumispaikkojen määrä riippuu tästä
toistumisluvusta. (Variable number of TR, VNTR).
MUC1 musiinilla
TR-luku voi vaihdella 20 ja 125 välillä. Tämän ensimmäiseksi
kloonatun musiinin solunulkoisen osan TR-jaksossa on seuraavat 20
aminohappoa (apomusiini) : (PAPGSTAPPAHGVTSAPDTR).
Tässä on alleviivattuna siitä kolme eri pätkää. Kun niitä on
tutkittu tarkemmin, on havaittu niiden seriinien(S)ja threoniinien (T)
tulevan glykosyloiduksi aivan tietyssä järjestyksessä ja
tietyillä entsyymeillä. Jos teoreettisia mahdollisuuksia
glykosyloitumiseen olisikin toistakymmentätuhatta, kuitenkin luonto
valitsee käyttöönsä aivan tiettyjä harvoja reittejä. Tämä
säätyminen on jollain tavalla korkealta tasolta, mutta ei
kuitenkaan DNA-säätöisesti suoraa, vaan säädössä on
monta hämärääkin kohtaa. Siis yleinen konsensussekvenssi puuttuu
glykosylaatiosta, Usea motiivi glykosyloidaan.
Eri musiinit, erilaiset
peptidit glykosyloidaan. Mikä glykosyylitransferaasi
kulloinkin aktivoituu, siihen taas vaikuttaa entsyymin määrä ja ekspressiokin
sekä enstyymikinetiikka - substraattihan siirtyy ensin endoplasmiseen
retikulumiin (ER) ja sieltä Golgin laitteen kautta. Musiinit, jotka ovat
sekreettejä (eritettyjä), menevät retikulumin läpi ja integraaliset
kiinnittyvät siihen. Säätelystä ohjautuu se oligosakkarituote,
mitä kulloinkin tarvitaan. pH myös neutraloituu, kun molekyyli menee
periferiaan päin Golgin laitteessa. Lisäksi havaitaan vahva
kudosspesifisyys ja diversiteeetti. Näistä näennäisesti laajoista
puitteista huolimatta ei mikään saa mennä vikaan ilman
kohtalokkaita seuraamuksia.
Useimmissa syöpälajeissa kuitenkin havaitaan musiinien olevan
muuntuneita. Syöpäkudosmusiinin ydinyksikkö (core) voi muuttua tyypiltään;
musiini saattaa alkaa sialyloitua liikaa, ja sialyltransferaaseja voi olla
liikaa ja normaalia glykosyloivaa entsyymiä taas liian vähän.
Glykaanituotteet, mitä syntyy, omaavat jotain loogista ominaisuutta: Tuumorille
ne antavat invasiivisuutta ja metatasoimiskykyjä, mutta jos tuumori
poistetaan, havaitaan näistä samaisista glykaaneista
tuumorisupressiivista ( kasvannaista vaimentavaa) vaikutusta. Malignissa transformaatiossa nämä
solupintaepitoopit, oligosakkaridiliitännäiset ovat useinkin
haarottumaan päin. Haaroja saadaan beeta (1,6) GlucNAc molekyylejä
liittämällä.
Musiinin biosynteesin eri vaiheita :
I. Polypeptidin seriini-
tai threoniini-aminohapon O-molekyyliin liittyy GalNac.
N-asetyyligalaktoosiaminin transferaasientsyymi on GalNAcT-
perhe.
Ihmisellä näitä on ainakin 11-12 kappaletta. Geneettisesti on
voitu määritellä entsyymit GalNAc-T8 ja GalNAc-T9.
Jokaisella on ainutlaatuinen substraattispesifisyys.
Esim. GalNAc-T4 glykosyloida vain edellämainitun
TR-jakson VTSA:sta seriinin (S) ja PDTR:stä threoniinin (T) ja
GSTA:sta seriinin (S) , jne.
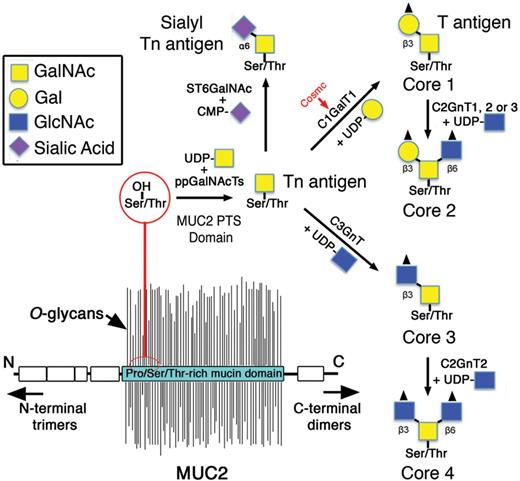
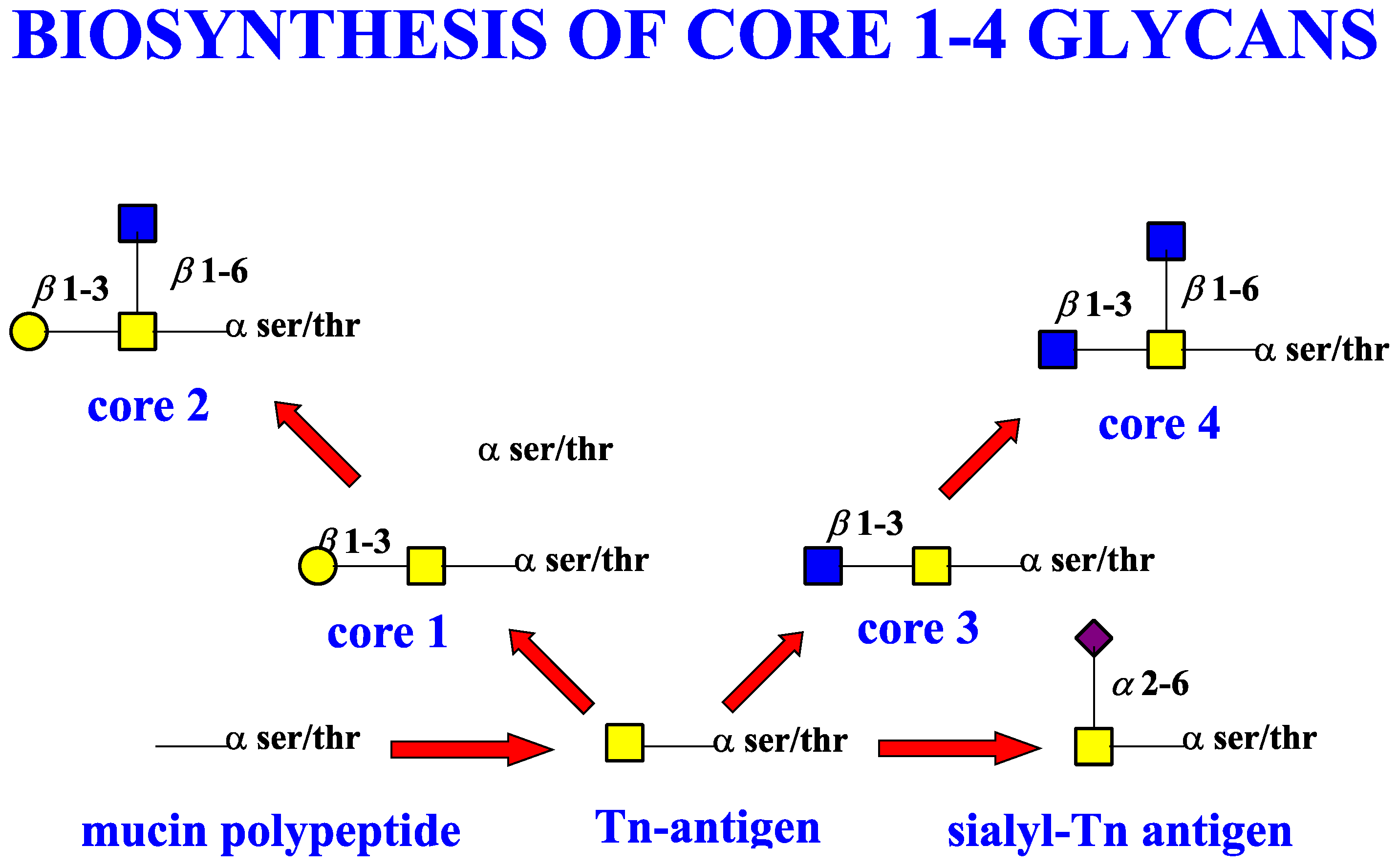
II Musiinin ydinosa
TYVI, ( core 1-8) kehittyy.
Näitä ytimiä tunnetaan kahdeksan erilaista. Ytimet valmistuvat
siten, että yksi tai useampi entsyymi lisää näitä
sakkaridiosia.
CORE 1 muodostuu siten, että entysyymi beeta (1,2) gal-T1 lisää
galaktoosin ( gal).
Tätä musiinityyppiä esiintyy monissa eri kuodksissa.
CORE 3 muodostuu siten, että entsyymi beeta (1.3)-GlcNAc-transferaasi
( beeta3Gn-T6) lisää N-asetyyliglukosaminin (GlcNAc) .
Nämä yllämainitut ovatkin kehon tavallisimmat musiinit. Tämä on
bronkiaalinen musiini. Myös paksusuolessa on tätä musiinilaatua.
CORE 2 muodostuu CORE 1:stä käsin siten, että siihen lisäytyy
GlcNAc. Entsyymiä merkataan C2GnT, Useampikin voi tehdä tätä
kakkosydintä.
C2GnT1 ja C2GnT3 tekevät vain kakkosydintä.
Tätä musiinia esiintyy monissa eri kudoksissa.
Jos tämä entsyymi C2GnT säätyy alas ja jos sialyloivat entyymit säätyvät ylös
(ST3Gal I ja II), voi tapahtua CORE 2 molekyylin muuntuma CORE
1-muotoon ja sialyloituminen, kuten rintasyövässä.
CORE 4 muodostuu kolmosytimestä (CORE3) johon on lisäytynyt
GlcNAc-molekyyli. Entsyymi joka pystyy tekemään tätä
nelosydintä (CORE 4), on C2GnT2. Siis se voi tehdä sekä kakkos- että
nelosydintä. Se voi tehdä myös i ja I-antigeenejä.
Tämä on bronkiaalinen musiini. Myös paksusuolessa on tätä
musiinilaatua.
CORE 5 ilmenee onkofetaalisesti. Sitä muodostaa alfa
1,3-GalNAc-transferaasi. Tätä esiintyy adenokarsinoomassa.
CORE 6 ilmenee myös onkofetaalisesti. Kun CORE 2 hajoaa, syntyy tätä
beeta-glukosidaasilla. Myös beeta1,6-GlcNAc-transferaasi voi tätä
tuottaa. Tätä esiintyy mahasyövössä.
CORE 7 on naudan submaksillaarisessa musiinissa
esiintyvä, ei ihmisellä. Tätä muodostavaa
glykosyylitransferaasia ei tunneta.
CORE 8 on ihmisen bronkiaalinen musiini. Tätä
glykosyylitransferaasia ei ole tarkemmin identifioitu.

III. Ketjun pidentyminen suorana ja
haaroittuneena
Suora ketju:
CORE- (ydin) osa kasvaa sitten runko-osana (BACKBONE) edelleen ja
siinä tulee olemaan poly-NAc-laktosamineja
Tyyppi 1 on (Gal beeta1-3GlcNAc)
Tyyppi 2 on Gal beeta1-4GlcNAc.
Pidentyminen tapahtuvat täten (tässähän samalla muodostuu
N-asetyylilaktosamineita!)
C3-asemaan lisätän galaktoosi (gal) GlcNAc-molekyyliin
C4-asemaan lisätään galaktoosi (gal) GlcNAc molekyyliin.
GlcNAc lisätään galaktoosin C3-asemaan.
Haaroittuminen tapahtuu seuraavasti:
Linkkiytyminen tehdään 1-6 asemiin, kuten GlcNAc beeta1,6 Gal.
Näissä reaktioissa tarvitaan
katalysoivia entsyymeitä.
Kaksi entsyymiä toimittaa galaktoosin(Gal) liittämisiä, toinen
tuottaa Tyyppi 1(poly)-Nac-laktosamineja ja toinen tyyppi 2 NAc-laktosamineja.
Tyyppi1 ketjun tuottajia on näissä beetaGal-transferaaseissa
( beeta 3Gal-T) viisi jäsentä.
Tyyppi 2 tuottajaentsyymeitä on kuusi jäsentä ( beeta 4Gal-T),
Useat glykosyylitransferaasit toimittavat GlcNAc molekyylin
liittämistä galaktoosiin.
Haarottumisia katalysoi beeta1,6 GlcNAc-transferaasit, jotka
ovat samankaltaisia kuin CORE2 tekijätkin (C2GnT2).
IV Ketjun päättäminen, epitoopin
terminaalisen osan muodostuminen
Lisätään runkoon fukoosi, sialihappo, galaktosamini tai joskus
harvoin galaktoosi. Voidaan myös sulfatoida NAc-laktosaminiyksikkö
(S) Näitä tekee eri glykosyylitransferaasit.:
Fukoosi (Fuc)
FUT-entsyymit, fukosyylitransferaasit katalysoivat seuraavien rakenteitten
muodostumista:
H-antigeeni, joka on rakenteeltaan Fuc alfa1,2Gal.
Lewis antigeeni, joka on Fuc alfa1-3/4Gal sidoksista.
Ihmisellä H-antigeenia muodostaa H-transferaasi ja Se-transferaasi.
FUT1 geeni koodaa H-transferaasia ja sitä on verta muodostavissa
soluissa.
FUT2 sekreettorigeeni koodaa Se- transferaasia. Niitä on erittävissä
kudoksissa ja musiinia tuottavissa soluissa.
Kuusi entsyymiä tekee niitä Lewis antigeeni rakenteita.
Fuc-T III-VII, IX.
Fuc-T III vaikuttaa, että syntyy substituoimaton, fukosyloitu ja
sialyloitu Lewis-antigeni.
Fuc-TVIII vaikuttaa, että Sialyl-Le x antigeenia kehittyy.
On olemassa kolmen eri tyypin sitoutumisia siaalihappoon.
NeuAc alfa2-3Gal ( esimerkki Si-Le a antigeeni, Si-Le x antigeeni,
Sd a/Cad)
NeuAc alfa2-6Gal ( esimerkki Sialyl-T antigeeni)
NeuAc alfa2-6GalNAc; ( Esimerkki Sialyl-Tn antigeeni
Siaalihapon lisäämistä tekee
suuri entsyymiperhe.
Sialyylitransferaasit (ST). Ne jaotellaan
sen mukaan, minkä sidoksen ne tekevät,. Ihmiseltä
on kloonattu näitä 15, imettäväisllä tavataan niitä 20
erilaista.
Jos molekyyli on jo ehtinyt fukosyloitua, se ei voi enää
sialyloitua. Sialyloitumisen täytyy siis tapahtua ennen
fukosyloitumista.
Sulfotransferaasit
Nämä entsyymit siirtävät PAPS-molekyylistä
sulfaattia musiinin oligosakkaridiin. Vain muutama sulfotransferaasi
on luonnehdittu. ( Ainakin aivojen sulfatidien synteesissä niissä on
vitamiini K koentsyymi ja pyridoksiini B6-vitamiini on entsyymiä negatiivisesti säätävä samassa reaktiossa sulfatidien
sulfotransferoitumishetkessä; myös arylsulfataasit tarvitsevat
vitamiini K koentsyymiä).
(PAPS on 3´- fosfoadenosiini-5´-fosfosulfaatti,
aktiivi sulfaatti).
Arveltavasti aktiivien rikkiryhmien merkitys on
tärkeä musiineissa, vaikka relevanssia on sanuttukin vielä
epäselväksi.
Terminaalinen galaktoosi tai GalNAc
esiintyy veriryhmissä A, B, Sd a ja Cad
antigeeneissä. Antigeeni on sinänsä väärä nimitys tälle
veriryhmien ter,inaaliselle oligosakkaridiepitoopille, mutta siihen
on totuttu näitten veriryhmätekijöitten suhteen. Nehän
ovat kudos. ja yksilöspesifisiä.
ABO-geenin polymorfia on veriryhmätekijöitten taustalla.
ABO-geeniperhe omaa sellaisia glykosyylitransferaasientsyymejä,
jotka katalysoivat A-epitoopin, B-epitoopin ja gal-gal
muodostumisen.
Tunnetaan neljä eri entsyymiä tässä yhteydessä.
Yksinkertainen H-antigeeni (O veriryhmä) on tämän entsyymin
akseptorina.
GalNAc-T-entsyymit tunnistavat UDP-GalNAc- molekyylin sytoplasmasta ja
siirtävät sen H-antigeeniin, jolloin muodostuu A-veriryhmän
epitooppi.
Vain neljän aminohapon muutos tuossa entsyymissä saattaa sen
valitsemaan sytoplasmasta UDP-Gal ja liittämään sen H-antigeeniin,
jolloin muodostuu B-veriryhmän tunnus oligosakkaridi.
ABO-veriryhmän entsyymit siis ovat joko alfa-GalNAc-transferaaseja
tai alfa-Gal-transferaaseja.
Musiinin O-glykosylaation
muuntumisesta
Malignia transformaatiota seuraa usein lisääntymää
beeta1-6GlcNAc-haaroittumisissa N-glykaaneissa ja lisääntynyttä
ilmenemistä O-glykaanien Lewis-epitoopeissa ja sialyl Tn esiintymää.
Sialyl-Lewis x on luonnollinen ligandi eräille selektiineille
endoteliaalisissa soluissa ja voi täten vaikuttaa tuumorin
kiinnittymistä endoteeliin.
Paksunsuolen syövän musiinissa MUC1 on
havaittu sialyl-Le a epitooppia. MUC1- jota on liikaa monissa
tuumoreissa, glykosyloituu poikkeavasti rintasyövässä,
paksunsuolen syövässä ja muissa karsinoomissa.
Mikrobi ja isäntäsolun mukosa
Limakalvo on fysikaalinen este bakteereille, mutta mukosa toimii myös
dynaamisesti lisäämällä musiinien tuotantoa ja pitoisuutta sekä
muuttamalla niitten glykosylaatiota.
Tästä seikasta on esimerkkejä, jossa voi oikeastaan havaita
”musiinien sodat ja kilpailut”. Niin isäntäsolu kuin
invasoituva mikrobi koettavat kumpikin muovata musiinit omaksi
edukseen. Invasoituva koettaa tehdä sen sellaiseksi, että se ei
estä infektoivan agenssin pyrkimyksiä, bakteerit jopa "syövät
musiinit" sokerina ravinnokseen.
Virus koettaa muuntaa siten, että
musiini ei pysty puolustamaan isäntäsolua ja huuhtomaan mikrobia
eritteissä pois kehosta.
Isäntäkehon lektiinit voivat täsmentää
musiinille bakteeria samalla opsonisaatioon ohjaten. Tuumorikasvu
myös modifioi musiinit ja tässä havitaan kaksinaisvaikutus.
Tuumoria edistävä ( invaasio, metastaasi) ja toisaalta isäntäsolua
hyödyttävä, tuumoria suppressoiva komponentti, joka tulee
postoperatiivisesti hyödyttämään.
Influenssavirus A hakeutuu tiettyihin siaalihapporakenteisiin ja se
voi modifioida asiaa siten, että siirtymä eläinkunnasta ihmisten
puolelle helpottuu sille.
Eläinten ja ihmisten musiinien välillä
on eroa, esim. simpanssille ei saa tarttumaan ihmisten flunssaa.
Jo varhain on ihmisten musiinit alkaneet olla kaksisuuntaisia:
Niitä on integraalisia ja eritemusiineja. Henkitorven epiteelillä
on luonnostaan sialyylioligosakkarideja ja ihmisen A-influenssan (IAV)
hemagglutiniini koettaa valita niitä reseptorikseen, IAV tunnistaa
erityisesti siaalihappo alfa2,6Gal-jaksoja, joita on
värekarvaepiteelissä. Luonnolliseti olisi hyvä katsoa, että
mikään samanaikainen bakteeri ei käy ”syömässä” musiinien
sokereita. Influenssan odoteltaessa kannattaa siis hoitaa hyvin
yleiskuntoa ja katsoa, että ravitsemus on riittävä, keuhkojen
tuuletus hyvä.
Ameballe musiini reagoi kuin muuttuen amebaksi itsekin, ottaa ameban
kiinni sen lektiineistä näillä epitoopeillaan ja runsas
musiinipitoinen lima irtoaa ja estää jo fysikalisestikin mikrobin
pääsemästä isäntäsoluun.

Inga kommentarer:
Skicka en kommentar