TRIM11, kromosomi
1q42.13
(Ensimmäisestä
kromosomista löytyvä TRIM on TRIM11 ( Muitakin on 1. kromosomissa
kuten TRIM17,-33,-45,-58,-62,-63 -ja 67. Katson nyt näitä 1
kromosomin TRIMEJÄ)
Siis TRIM11. Sen
entsyymikoodi on EC.2.3.2.27. Sen muita nimiä ovat RNF92 eli se on
RING finger proteiini 92. Lisäksi sillä on nimi: proteiini B1A1.
Se edistää
liukenemattomien ubikitinoitujen proteiinien hajoittamista ja näihin
proteiineihin kuuluu PAX6, polyglutamiinitoistolla laajentunut HTT
ja polyalaniinitoistolla laajentunut ARX. TRIM11 välittää
PAX6-ubikitinaatiota johtaen sitä proteosomisilppuriin, ja tällä
se pystyy moduloimaan kortikaalista neurogeneesiä.
-
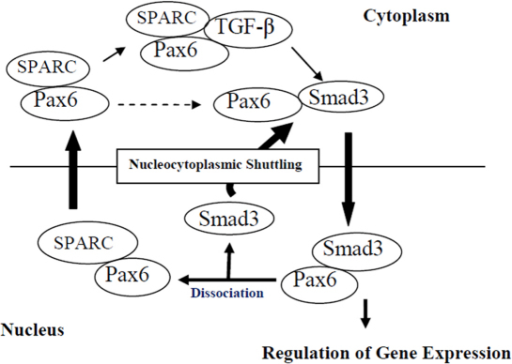
(Etsin tätä PAX6 tekijää. Esim. silmässä PAX6 (Paired Box 6) tekee sukkulointia solutuman ja sytoplasman välillä Smad3 -signalointitiessä ja on tärkeä silmän morfogeneesissä ja funktionqaalisessa anatomiassa. PAX6 funktiot säätelee TGFbeta ja SPARC vaikuttaen sen sukkulointiin tuman ja sytoplasman välillä- (Nucleocytoplasmic shuttling). (SPARC= Secrfeted protein acidic and rich in cysteine)- Oletettu sykli on kuvattu alalolevassa linkissä. Siitä huomaa että PAX6 voi irrota sytoplasmassa näistä mainituista tekijöistä( katkoviiva) jolloin se saattaa joutua TRIM11 vaikutukseen ja ubikitinoitua. Arvelen. Jos TRIM11 on tuman puolella, se voi havaita myös PAX6 irtonaisena, kun se on irtomassa SMAD3:asta ja siirtymässä SPARC kompleksissa ulos tumasta. PAX6 sinänsä on transkriptiotekijä.
Lisäksi TRIM11
säätelee humaiinin (HN) tai sitä sisältävien proteiinin solun
sisäistä pitoisuutta proteosomisilppuritienkautta .
Välittää myös
MED15 ubikitinaatiota ja jothaa hajoitukseen silppurissa.
TRIM11 saataa myös
osaltaan osallistua luonnolliseen retroviruksia rajoitavaan
immuniteettiin. Jos TRIM11 on yliexpressoitunut, se vähentää
HIV-1 viruksen ja hiiren leukemiaviruksen infektiivisyyttä
vaimentamalla virusgeenin ilmenemää. Antivirusaktiviteeti riippuu
funktionaalisesta E3 ubikitiini-proteiiniligaasi-domaanista.
TRIM11 saattaa
säädellä TRIM5 vaihtumista proteosomitien kautta ja siten se
vastavaikuttaa TRIM5- välitteiseen retrovirusten aiheuttamien
infetioiden restriktioon retroviruksen elinsyklin varhaisvaiheissa.
UniProtKB - Q96F44 (TRI11_HUMAN)
-
E3 ubiquitin-protein ligase that promotes the degradation of insoluble ubiquitinated proteins, including insoluble PAX6, poly-Gln repeat expanded HTT and poly-Ala repeat expanded ARX.
-
Mediates PAX6 ubiquitination leading to proteasomal degradation, thereby modulating cortical neurogenesis. May also inhibit PAX6 transcriptional activity, possibly in part by preventing the binding of PAX6 to its consensus sequences.
-
May contribute to the regulation of the intracellular level of HN (humanin) or HN-containing proteins through the proteasomal degradation pathway.
-
Mediates MED15 ubiquitination leading to proteasomal degradation.
-
May contribute to the innate restriction of retroviruses. Upon overexpression, reduces HIV-1 and murine leukemia virus infectivity, by suppressing viral gene expression. Antiviral activity depends on a functional E3 ubiquitin-protein ligase domain.
-
May regulate TRIM5 turnover via the proteasome pathway, thus counteracting the TRIM5-mediated cross-species restriction of retroviral infection at early stages of the retroviral life cycle.
Catalytic activity:
S-ubiquitinyl-[E2
ubiquitin-conjugating enzyme]-L-cysteine + [acceptor
protein]-L-lysine = [E2 ubiquitin-conjugating enzyme]-L-cysteine +
N6-ubiquitinyl-[acceptor protein]-L-lysine.
Pathwayi:
protein ubiquitination
This protein is
involved in the pathway protein ubiquitination, which is part of
Protein modification.
View all proteins of this organism that are known to be involved in the pathway protein ubiquitination and in Protein modification.
View all proteins of this organism that are known to be involved in the pathway protein ubiquitination and in Protein modification.
MIKÄ ON PAX6?
https://munin.uit.no/bitstream/handle/10037/12153/thesis.pdf?sequence=4
https://openi.nlm.nih.gov/detailedresult.php?img=PMC3335779_mv-v18-951-f4&req=4
Haku PubMed
https://www.ncbi.nlm.nih.gov/pubmed/29434302
Glioblastoma PAX6 on oncogeeni :
https://www.ncbi.nlm.nih.gov/pubmed/27863244
Glioblastoma
stem cells (GSCs) are implicated in tumor neovascularization,
invasiveness, and therapeutic resistance. To illuminate mechanisms
governing these hallmark features, we developed a de novo glioblastoma
multiforme (GBM) model derived from immortalized human neural
stem/progenitor cells (hNSCs) to enable precise system-level comparisons
of pre-malignant and oncogene-induced malignant states of NSCs. Integrated transcriptomic and epigenomic analyses uncovered a PAX6/DLX5
transcriptional program driving WNT5A-mediated GSC differentiation into
endothelial-like cells (GdECs). GdECs recruit existing endothelial
cells to promote peritumoral satellite lesions, which serve as a niche
supporting the growth of invasive glioma cells away from the primary
tumor. Clinical data reveal higher WNT5A and GdECs expression in
peritumoral and recurrent GBMs relative to matched intratumoral and
primary GBMs, respectively, supporting WNT5A-mediated GSC
differentiation and invasive growth in disease recurrence. Thus, the PAX6/DLX5-WNT5A
axis governs the diffuse spread of glioma cells throughout the brain
parenchyma, contributing to the lethality of GBM.

Inga kommentarer:
Skicka en kommentar