17. Ruan H-B, Nie Y, Yang X. Regulation of protein degradation by
O-GlcNAcylation: crosstalk with ubiquitination. Mol Cell
Proteomics (2013) 12:3489–97. doi: 10.1074/mcp.R113.029751
PubMed
Abstract | CrossRef
Full Text | Google
Scholar
Leta i den här bloggen

tisdag 27 november 2018
måndag 26 november 2018
söndag 25 november 2018
Kitiinipitoiset ruoat ihmissuoliston sulatettavana . Kitinaaseista lähteitä
- (1) Role of Chitinases in Human Stomachfor Chitin Digestion: AMCase in theGastric Digestion of Chitin and Chit inGastric Pathologiehttps://pdfs.semanticscholar.org/9135/9116af060af3541a99532c6d13c2cb4dadc6.pdf
(2)
Mikä kliininen merkitys on kitinaaseilla, joita toisilla ihmisillä on? Suomeksi löytyy tekstiä vuodelta 2004.
http://vintti.yle.fi/yle.fi/genreportaalit/portaali-1941.html?genre=terveys&osannimi=tutkittua_allergiat&jutunid=2596
Astma ja kitiini 14.6.2004 Science/YLE Radio 1 TiedeuutiseAstmaa sairastavien hiirten keukokudoksista löydetty yhdiste, kitinaasi, tuo uusia käsityksiä astman synnystä. Se avaa myös uusia hoitomahdollisuuksia, uskovat löydön esitelleet amerikkalaistutkijat.Astmaattisten hiirten keuhkokudoksissa olevista pienistä kiteistä eristettiin kitinaasia ja tutkijat ryhtyivät pohtimaan miten ne liittyvät astmaan. Myös astmaa sairastavien ihmisten keuhkoista löytyi kitinaasia, mutta ei-astmaattisten ihmisten keuhkoista sitä ei löydetty lainkaan. Hiirikokeissa pystyttiin osoittamaan, että elimistön puolustusreaktio ja erityisesti niinkutsutut T2-auttajasolut lisäsivät kitinaasin tuotantoa keuhkokudoksissa. Kun kitinaasin toiminta estettiin, keuhkojen tulehdus ja astmareaktio helpotti. Astma on keuhkojen liioteltu reaktio sinänsä viattomiin ärsykkeisiin, mutta sen käynnistymiseen johtavaa mekanismia ei tunneta. Kitiini on mm. hyönteisten kuoren tärkeä rakennusaine ja kitinaasit ovat sitä hajottavia yhdisteitä. Kitiiniä on myös sienisolujen seinämissä, äyriäisten kuorissa ja joissakin loiseläimissä. Yksinkertaisissa eliöissä kitinaasientsyymit ovat osa elimistön suojareaktiota, jolla tuhotaan niihin pyrkiviä loiseläimiä. Myös imettäväisillä on kitinaaseja tuottavia geenejä, ihmiselläkin niitä on puolenkymmentä ja niitä on pidetty lähinnä kehityksellisinä jäänteinä. Onko astma elimistön reaktio kitiinipitoisen loisen hyökkäykseen, jää selvitettäväksi, mutta löytö avaa uusia keinoja astmalääkkeiden kehittämiseen ja sen syntymekanismin selvittämiseen. (3) Maisterityö (PhD) Helsingin Yliopistosta kuusen kitinaaseista. Kitinaasit katalysoivat beta-1,4- NAcGlcAm yksiköiden pilkkoutumista. https://helda.helsinki.fi/bitstream/handle/10138/176912/solunulk.pdf (4) Duodecim (1999) kitinaaseista: https://www.duodecimlehti.fi/api/pdf/duo91159 Duodecim mainitsee kasvien I- luokan kitinaaseista, jotka voivat olla panallergeeneja lateksi-hedelmä-allergian taustalla. Kastanja ja avokadoallergiatekijöissä on taustalla I-kitinaasin ja lateksin ristiallergia. Muittenkin hedelmäallergioitten takana voi tällaista piillä: kiivi, papaija, banaani, viikuna, passiohedelmät). (5) Exoentsyymitutkimus puroisista http://bada.hb.se/bitstream/2320/9667/1/Claesson%20Keckman.pdf |
Etiketter:
Dietäärinen kitiini,
kitinaasien merkitys ihmisellä
Chitolectin domain- - pohdittavaksi antimikrobivaikutuksen vuoksi YKL-39

- YKL-39,
- YKL-40 (HCGP39),
- YM1, oviductin, and
- AMCase (acidic mammalian chitinase),
- as well as catalytically active chitotriosidases.
Chitotriosidase is a chitinolytic enzyme expressed in maturing macrophages, which suggests that it plays a part in antimicrobial defense.
Chitotriosidase hydrolyzes chitotriose, as well as colloidal chitin to yield chitobiose and is therefore considered an exochitinase. Chitotriosidase occurs in two major forms, the large form being converted to the small form by either RNA or post-translational processing. Although the small form, containing the chitinase domain alone, is sufficient for the chitinolytic activity, the additional C-terminal chitin-binding domain of the large form plays a role in processing colloidal chitin.
The chitotriosidase gene is nonessential in humans, as about 35% of the population are heterozygous and 6% homozygous for an inactivated form of the gene.
HCGP39 is a 39-kDa human cartilage glycoprotein thought to play a role
Katson hieman näitä peptideitä:
(1) YKL-39, CHI3K2, (1p13.2)
- Also known as
- CHIL2; YKL39; YKL-39
- Summary
- The protein encoded by this gene is similar to bacterial chitinases but lacks chitinase activity. The encoded protein is secreted and is involved in cartilage biogenesis. Several transcript variants encoding different isoforms have been found for this gene. [provided by RefSeq, Apr 2012]
- Expression
- Biased expression in appendix (RPKM 55.9), salivary gland (RPKM 27.1) and 11 other tissues See more
- Orthologs all
- Preferred Names
- chitinase-3-like protein 2
- Names
- chondrocyte protein 39
- Conserved Domains (2) summary
-
- cd02872
Location:19 → 377 - GH18_chitolectin_chitotriosidase; This conserved domain family includes a large number of catalytically inactive chitinase-like lectins (chitolectins) including YKL-39, YKL-40 (HCGP39), YM1, oviductin, and AMCase (acidic mammalian chitinase), as well as catalytically active ...
- smart00636
Location:18 → 355 - Glyco_18; Glyco_18 domain
- cd02872
Related articles in PubMed
- Structural and thermodynamic insights into chitooligosaccharide binding to human cartilage chitinase 3-like protein 2 (CHI3L2 or YKL-39). Ranok A, et al. J Biol Chem, 2015 Jan 30. PMID 25477513, Free PMC Article
- Human YKL39 (chitinase 3-like protein 2), an osteoarthritis-associated gene, enhances proliferation and type II collagen expression in ATDC5 cells. Miyatake K, et al. Biochem Biophys Res Commun, 2013 Feb 1. PMID 23291184
- Human YKL-39 is a pseudo-chitinase with retained chitooligosaccharide-binding properties. Schimpl M, et al. Biochem J, 2012 Aug 15. PMID 22742450, Free PMC Article
- Isolation and sequence of a novel human chondrocyte protein related to mammalian members of the chitinase protein family. Hu B, et al. J Biol Chem, 1996 Aug 9. PMID 8702629
- CHI3L1 and CHI3L2 overexpression in motor cortex and spinal cord of sALS patients. Sanfilippo C, et al. Mol Cell Neurosci, 2017 Dec. PMID 28989002
GeneRIFs: Gene References Into Functions
- This study suggests that CHI3L1 and CHI3L2 are associated with the progression of neurodegeneration in motor cortex and spinal cord of Amyotrophic Lateral Sclerosis patients.
- This study shown that CHI3L2 is regulated differently in healthy and late onset Alzheimer"s disease brain depending on the sex.
- This review comprehensively analyzes recent data about expression pattern, and involvement of human YKL-40, YKL-39 and SI-CLP in cancer. [review]
- cerebrospinal fluid CHI3L1 and CHI3L2 and serum CHI3L1 might help to define multiple sclerosis disease stage
- Structural analysis demonstrates that YKL-39 interacts with chitooligosaccharides through hydrogen bonds and hydrophobic interactions. Thermodynamic analysis indicates that binding of chitooligosaccharide to YKL-39 is mainly driven by enthalpy.
- These data suggest that hYKL-39 is a novel growth and differentiation factor involved in cartilage homeostasis.
- YKL-39 possesses a chitinase-like fold, but lacks key active-site residues required for catalysis.
- ERK1/2 phosphorylation by CHI3L2 inhibits cell mitogenesis and proliferation.
- Clinical trial of gene-disease association and gene-environment interaction. (HuGE Navigator)
- human chitinase 3-like 2 gene (YKL-39) but not chitinase 3-like 1 gene (YKL-40) is upregulated in osteoarthritic cartilage
https://www.ncbi.nlm.nih.gov/protein/NP_003991.2
ORIGIN 1 mgattmdqks lwagvvvlll lqggsayklv cyftnwsqdr qepgkftpen idpflcshli 61 ysfasiennk viikdksevm lyqtinslkt knpklkills iggylfgskg fhpmvdssts 121 rlefinsiil flrnhnfdgl dvswiypdqk enthftvlih elaeafqkdf tkstkerlll 181 tagvsagrqm idnsyqvekl akdldfinll sfdfhgswek plitghnspl skgwqdrgps 241 syynveyavg ywihkgmpse kvvmgiptyg hsftlasaet tvgapasgpg aagpitessg 301 flayyeicqf lkgakitrlq dqqvpyavkg nqwvgyddvk smetkvqflk nlnlggamiw 361 sidmddftgk scnqgpyplv qavkrslgsl
The name YKL-39: ( 39 leusins, , many tyrosins, Y and lysins, K).
torsdag 22 november 2018
: ASB2 (14q32.13 ) ASB E3 ligaasien alaryhmä CRL ubikitiiniligaaseissa (Cul-RING ligaasit)
Olen katsomassa filamiiniryhmää ja aloitin etsimällä Filamiini- proteiinin hajoittajaa proteosomijärjstelmästä. Löysin uuden E3 ubikitiiniligaasin, josta en ole aiemmnin tehnyt merkintöjä.
Asetan etiketin: E3 ubikitiiniligaasit (muut) Muut, kuin jo minun havaitsemani luokitellut ryhmät.
PubMed viiteistä löytyy tämän E3 ubikitiiniligaasin ryhmäksi
ASB2α cullin-ring E3 ubiquitin ligase
( Tässä E3 ub. ligaasien ala ryhmissä on jo:
_ SCF-type,
VHL-type,
BTH-type,
APL- type,
mutta en velä tiedä mikä alatyyppi on tämä ASB-tyyppi.
https://www.ncbi.nlm.nih.gov/gene/51676
ASB2 geeni (14q32.12)
Tämä geeni kuuluu perheeseen, jonka nimi on ankyriinitoiston(ANK) ja SOCS- boxin omaavien proteiinien perhe.
Nämä proteiinit omaavat osaa proteiinien hajoituksessa kytkemällä sytokiinisignalointia vaimentvia proteiineja elongiin iBC- kompleksiinsa.
. Geenin koodaama proteiini on eräs alayksikköä multimeerisessä E3 ubikitiiniligaasikomplesissa, joka välittää aktiiniin sitoutuvien proteiinien hajoittamista. Tällä geenillä on osuutta retiinihapon indusoimassa myeloisten leukemiasolujen kasvun estossa ja erilaistumisessa . Alternatiivisesti pleissautuneet transkriptivariantit koodavat monia isoformeja. Geeniä ilmenee sydämessä, eturauhasessa ja 12 muussa kudoksessa.
Asetan etiketin: E3 ubikitiiniligaasit (muut) Muut, kuin jo minun havaitsemani luokitellut ryhmät.
PubMed viiteistä löytyy tämän E3 ubikitiiniligaasin ryhmäksi
ASB2α cullin-ring E3 ubiquitin ligase
( Tässä E3 ub. ligaasien ala ryhmissä on jo:
_ SCF-type,
VHL-type,
BTH-type,
APL- type,
mutta en velä tiedä mikä alatyyppi on tämä ASB-tyyppi.
https://www.ncbi.nlm.nih.gov/gene/51676
ASB2 geeni (14q32.12)
Tämä geeni kuuluu perheeseen, jonka nimi on ankyriinitoiston(ANK) ja SOCS- boxin omaavien proteiinien perhe.
Nämä proteiinit omaavat osaa proteiinien hajoituksessa kytkemällä sytokiinisignalointia vaimentvia proteiineja elongiin iBC- kompleksiinsa.
. Geenin koodaama proteiini on eräs alayksikköä multimeerisessä E3 ubikitiiniligaasikomplesissa, joka välittää aktiiniin sitoutuvien proteiinien hajoittamista. Tällä geenillä on osuutta retiinihapon indusoimassa myeloisten leukemiasolujen kasvun estossa ja erilaistumisessa . Alternatiivisesti pleissautuneet transkriptivariantit koodavat monia isoformeja. Geeniä ilmenee sydämessä, eturauhasessa ja 12 muussa kudoksessa.
- Also known as ASB-2
- Summary This gene encodes a member of the ankyrin repeat and SOCS box-containing (ASB) protein family. These proteins play a role in protein degradation by coupling suppressor of cytokine signalling (SOCS) proteins with the elongin BC complex. The encoded protein is a subunit of a multimeric E3 ubiquitin ligase complex that mediates the degradation of actin-binding proteins. This gene plays a role in retinoic acid-induced growth inhibition and differentiation of myeloid leukemia cells. Alternatively spliced transcript variants encoding multiple isoforms have been observed for this gene. [provided by RefSeq, Jan 2011]
- Expression Biased expression in heart (RPKM 15.5), prostate (RPKM 8.6) and 12 other tissues
- Conserved Domains (4) summary
-
- cd00204
Location:232 → 357 - ANK; ankyrin repeats; ankyrin repeats mediate protein-protein interactions in very diverse families of proteins. The number of ANK repeats in a protein can range from 2 to over 20 (ankyrins, for example). ANK repeats may occur in combinations with other types of domains. The structural repeat unit contains two antiparallel helices and a beta-hairpin, repeats are stacked in a superhelical arrangement; this alignment contains 4 consecutive repeats.
- cd03721
Location:591 → 635 - SOCS_ASB2; SOCS (suppressors of cytokine signaling) box of ASB2-like proteins. ASB family members have a C-terminal SOCS box and an N-terminal ankyrin-related sequence. ASB2 targets specific proteins to destruction by the proteasome in leukemia cells that have been induced to differentiate. The general function of the SOCS box is the recruitment of the ubiquitin-transferase system. The SOCS box interacts with Elongins B and C, Cullin-5 or Cullin-2, Rbx-1, and E2. Therefore, SOCS-box-containing proteins probably function as E3 ubiquitin ligases and mediate the degradation of proteins associated through their N-terminal regions.
- pfam12796
Location:308 → 396 - Ank_2; Ankyrin repeats (3 copies)
- sd00045
Location:237 → 268 - ANK; ANK repeat [structural motif]
- cd00204
ORIGIN 1 matqistrgs qctigqeeys lysslsedel vqmaieqsla dktrgpttae atasactnrq 61 pahfypwtrs tappesspar apmglfqgvm qkyssslfkt sqlapadpli kaikdgdeea 121 lktmikegkn laepnkegwl plheaayygq vgclkvlqra ypgtidqrtl qeetavylat 181 crghldclls llqagaepdi snksretply kacerknaea vkilvqhnad tnhrcnrgwt 241 alhesvsrnd levmqilvsg gakvesknay gitplfvaaq sgqlealrfl akygadintq 301 asdnasalye ackneheevv efllsqgada nktnkdgllp lhiaskkgny rivqmllpvt 361 srtrirrsgv splhlaaern hdevlealls arfdvntpla perarlyedr rssalyfavv 421 nnnvyatell lqhgadpnrd vispllvair hgclrtmqll ldhganiday iathptafpa 481 timfamkcls llkflmdlgc dgepcfscly gngphppapq pssrfndapa adkepsvvqf 541 cefvsapevs rwagpiidvl ldyvgnvqlc srlkehidsf edwavikeka epprplahlc 601 rlrvrkaigk yriklldtlp lpgrlirylk yentq
Related articles in PubMed
- Filamins but not Janus kinases are substrates of the ASB2α cullin-ring E3 ubiquitin ligase in hematopoietic cells. Lamsoul I, et al. PLoS One, 2012. PMID 22916308, Free PMC Article
- The ASB2β Ubiquitin-interacting motif is involved in its monoubiquitination. Nishiyama T, et al. Biochem Biophys Res Commun, 2012 Apr 13. PMID 22382022
- A label-free quantitative proteomics strategy to identify E3 ubiquitin ligase substrates targeted to proteasome degradation. Burande CF, et al. Mol Cell Proteomics, 2009 Jul. PMID 19376791, Free PMC Article
- ASB-2 inhibits growth and promotes commitment in myeloid leukemia cells. Guibal FC, et al. J Biol Chem, 2002 Jan 4. PMID 11682484
- ATRA-regulated Asb-2 gene induced in differentiation of HL-60 leukemia cells. Kohroki J, et al. FEBS Lett, 2001 Sep 14. PMID 11566180
FEBS Lett. 2001 Sep 14;505(2):223-8.
ATRA-regulated Asb-2 gene induced in differentiation of HL-60 leukemia cells.
Suppressors
of cytokine signaling (SOCS) proteins possess common structures, a SOCS
box at the C-terminus and a SH2 domain at their center. These
suppressors are inducible in response to cytokines and act as negative
regulators of cytokine signaling.
The ASB proteins also contain the SOCS box and the ankyrin repeat sequence at the N-terminus, but do not have the SH2 domain.
Although Socs genes are directly induced by several cytokines, no Asb gene inducers have been identified. In this study, we screened the specific genes expressed in the course of differentiation of HL-60 cells, and demonstrated that ASB-2, one of the ASB proteins, was rapidly induced by all-trans retinoic acid (ATRA). Typical retinoid receptors (RARs) or retinoid X receptors (RXRs) binding element (RARE/RXRE) were presented in the promoter of the Asb-2 gene. We showed that RARalpha, one of the RARs, binds to the RARE/RXRE in the Asb-2 promoter. In addition, we demonstrated by luciferase reporter assay that this element was a functional RARE/RXRE. These findings indicate that ASB-2 is directly induced by ATRA and may act as a significant regulator, underlying such physiological processes as cell differentiation.
The ASB proteins also contain the SOCS box and the ankyrin repeat sequence at the N-terminus, but do not have the SH2 domain.
Although Socs genes are directly induced by several cytokines, no Asb gene inducers have been identified. In this study, we screened the specific genes expressed in the course of differentiation of HL-60 cells, and demonstrated that ASB-2, one of the ASB proteins, was rapidly induced by all-trans retinoic acid (ATRA). Typical retinoid receptors (RARs) or retinoid X receptors (RXRs) binding element (RARE/RXRE) were presented in the promoter of the Asb-2 gene. We showed that RARalpha, one of the RARs, binds to the RARE/RXRE in the Asb-2 promoter. In addition, we demonstrated by luciferase reporter assay that this element was a functional RARE/RXRE. These findings indicate that ASB-2 is directly induced by ATRA and may act as a significant regulator, underlying such physiological processes as cell differentiation.
GeneRIFs: Gene References Into Functions
- Notch signaling can initiate Asb2 transcription and NF-kappa B activation in T cell acute lymphoblastic leukemia cells.
- Using ASB2 conditional knockout mice.
- Phosphorylation of serine 323 of ASB2 alpha by Erk kinases is critical for ASB2alpha-mediated degradation of FLNA.
- data therefore reveal ubiquitin acceptor sites in FLNa and establish that ASB2alpha-mediated effects on cell spreading are due to loss of filamins.
- Data show that neither endogenous nor exogenously expressed ASB2alpha induces degradation of JAK proteins in hematopoietic cells
- These results suggest that ASB2beta but not ASB2alpha might be monoubiquitinated and that the ASB2beta UIM motif, but not its E3 Ub ligase activity, plays a pivotal role in this monoubiquitination.
- A model whereby ASB2 contributes to hematopoietic differentiation, in part, through MLL degradation and HOX gene down-regulation.
- ASB2alpha is a novel regulator of integrin-dependent adhesion of hematopoietic cells
- By shifting monomeric E3 ligase complexes to dimeric forms through activation of Asb2 transcription, Notch could effectively control the turnover of a variety of substrates and it exerts diverse effects on cell proliferation and differentiation.
- ASB2 may regulate hematopoietic cell differentiation by modulating cell spreading and actin remodeling through targeting of filamins A and B for degradation.
Cell Res. 2011 May;21(5):754-69. doi: 10.1038/cr.2010.165. Epub 2010 Nov 30.
Notch-induced Asb2 expression promotes protein ubiquitination by forming non-canonical E3 ligase complexes.Nie L1, Zhao Y, Wu W, Yang YZ, Wang HC, Sun XH. Abstract
Notch
signaling controls multiple developmental processes, thus demanding
versatile functions. We have previously shown that this may be partly
achieved by accelerating ubiquitin-mediated degradation of important
regulators of differentiation. However, the underlying mechanism was
unknown. We now find that Notch signaling transcriptionally activates
the gene encoding ankyrin-repeat SOCS box-containing protein 2 (Asb2).
Asb2 promotes the ubiquitination of Notch targets such as E2A and Janus kinase (Jak) 2, and a dominant-negative (DN) mutant of Asb2 blocks Notch-induced degradation of these proteins. Asb2 likely binds Jak2 directly but associates with E2A through Skp2. We next provide evidence to suggest that Asb2 bridges the formation of non-canonical cullin-based complexes through interaction with not only ElonginB/C and Cullin (Cul) 5, but also the F-box-containing protein, Skp2, which is known to associate with Skp1 and Cul1. Consistently, ablating the function of Cul1 or Cul5 using DN mutants or siRNAs protected both E2A and Jak2 from Asb2-mediated or Notch-induced degradation. By shifting monomeric E3 ligase complexes to dimeric forms through activation of Asb2 transcription, Notch could effectively control the turnover of a variety of substrates and it exerts diverse effects on cell proliferation and differentiation.PMID:21119685DOI:10.1038/cr.2010.165
Asb2 promotes the ubiquitination of Notch targets such as E2A and Janus kinase (Jak) 2, and a dominant-negative (DN) mutant of Asb2 blocks Notch-induced degradation of these proteins. Asb2 likely binds Jak2 directly but associates with E2A through Skp2. We next provide evidence to suggest that Asb2 bridges the formation of non-canonical cullin-based complexes through interaction with not only ElonginB/C and Cullin (Cul) 5, but also the F-box-containing protein, Skp2, which is known to associate with Skp1 and Cul1. Consistently, ablating the function of Cul1 or Cul5 using DN mutants or siRNAs protected both E2A and Jak2 from Asb2-mediated or Notch-induced degradation. By shifting monomeric E3 ligase complexes to dimeric forms through activation of Asb2 transcription, Notch could effectively control the turnover of a variety of substrates and it exerts diverse effects on cell proliferation and differentiation.PMID:21119685DOI:10.1038/cr.2010.165
onsdag 21 november 2018
FOXF2 ( 6p25.3) geenistä, ( Forkhead transcription factor ) 2015 thesis Azadeh Reyahi.
Geeni FOXF2(6p25.3)
https://www.ncbi.nlm.nih.gov/gene/2295
https://www.sciencedirect.com/science/article/pii/S001216061530333X
https://gupea.ub.gu.se/handle/2077/40458
Foxf2 gene in development and disease Azadeh Reyahi Department of Chemistry and Molecular Biology, University of Gothenburg, Box 462, SE 405 30, Göteborg, Sweden
Abstract In this thesis I present our recent data on the involvement and the mechanism of action of the forkhead transcription factor Foxf2 in
Reduced proliferation and decreased extracellular matrix production in the neural crest-derived mesenchyme of the palatal shelves was found to be responsible for the cleft palate phenotype in Foxf2 null mutants. Mechanistically, the defect is associated with reduced canonical Tgfβ signaling and integrin expression. The Tgfb2 mRNA level was not affected, but the amount of Tgfβ2 protein was significantly decreased in mutant palatal shelf mesenchyme.
Foxf2 Is Required for Brain Pericyte Differentiation and Development and Maintenance of the Blood-Brain Barrier. Reyahi A1, Nik AM1, Ghiami M1, Gritli-Linde A2, Pontén F3, Johansson BR4, CarlssonP5.
VISA ARTIKEL
Foxf2 in intestinal fibroblasts reduces numbers of Lgr5(+) stem cells and adenoma formation by inhibiting Wnt signaling. Nik AM1, Reyahi A, Pontén F, Carlsson P.
VISA ARTIKEL
FOXF2, a novel risk locus for stroke and small artery disease Ganesh Chauhan, Corey R Arnold, Audrey Y Chu, Myriam Fornage, Azadeh Reyahi, Joshua C Bis, Aki S Havulinna (equal contribution first authors) ... additional co-authors excluded for brevity... (joint senior authors:) Lenore J Launer, M Arfan Ikram, Peter Carlsson, Daniel I Chasman, Sarah J Childs, William T Longstreth, Jr, Sudha Seshadri, Stéphanie Debette. Submitted
Foxf2 enhances Tgfβ signaling in secondary palate development Ali M.Nik, Jeanette Astroga-Johansson, Azadeh Reyahi, Mozhgan Ghiami, Fredrik Pontén and Peter Carlsson.
https://www.ncbi.nlm.nih.gov/gene/2295
https://www.sciencedirect.com/science/article/pii/S001216061530333X
- Also known as
- FKHL6; FREAC2; FREAC-2
- Summary
- FOXF2 encodes forkhead box F2, one of many human homologues of the Drosophila melanogaster transcription factor forkhead. FOXF2 is expressed in lung and placenta, and has been shown to transcriptionally activate several lung-specific genes. [provided by RefSeq, Jul 2008]
- Expression
- Biased expression in lung (RPKM 8.4), prostate (RPKM 6.0) and 13 other tissues See more
- Orthologs
- mouse all
- Preferred Names
- forkhead box protein F2
- Names
- forkhead-like 6
- forkhead-related activator 2
- forkhead-related protein FKHL6
- forkhead-related transcription factor 2
https://www.ncbi.nlm.nih.gov/protein/NP_001443.1
Cleft lip and palate :
- Cleft lip and cleft palate ongoing research
- Some of the ongoing research studies on Cleft lip and cleft palate in Singapore are Novel evidence of association with nonsyndromic cleft lip with or without cleft palate was shown for single nucleotide polymorphisms in FOXF2 gene in an Asian population, Congenital midline sinus of the upper lip.
- Töllö viikolla tuli postista kirje "Operation Smile" . Ruotsalainen projekti jossa kerätäänv aroja kitalaki-huulihalkiolasten plastiikkakirugiseen kasvokorjaukseen, joka on todella hymyn palauttatja. mainoskessa kerrotiin pienestä pojasta jolla oli joopa molemmanpuolinen huulihalkio ja ikätoverit olivat jopa kivittäneet pientä . Hän sai palstiikkakirurgisen korjauksen ja aksvot palautuivat aivaon normaaleiksi. taitavien kirurgien kräsivällisen operaatiosarjan avulla. tästä saa enemmän tietoja www.operationsmile.se/
Mitä mahdollisuuksia geenikorjauksella on, sen tulevaisuus tietää. Tämä eeni on monessa ihmistaudissa osallisena:
Related articles in PubMed
- FOXF2 deficiency promotes hepatocellular carcinoma metastasis by inducing mesenchymal-epithelial transition. Dou C, et al. Cancer Biomark, 2017 Jul 4. PMID 28582850
- FOXF2 promoter methylation is associated with prognosis in esophageal squamous cell carcinoma. Chen X, et al. Tumour Biol, 2017 Feb. PMID 28222662
- Decreased expression of FOXF2 as new predictor of poor prognosis in stage I non-small cell lung cancer. Kong PZ, et al. Oncotarget, 2016 Aug 23. PMID 27487137, Free PMC Article
- The dual role of FOXF2 in regulation of DNA replication and the epithelial-mesenchymal transition in breast cancer progression. Lo PK, et al. Cell Signal, 2016 Oct. PMID 27377963, Free PMC Article
- Novel evidence of association with nonsyndromic cleft lip with or without cleft palate was shown for single nucleotide polymorphisms in FOXF2 gene in an Asian population. Bu L, et al. Birth Defects Res A Clin Mol Teratol, 2015 Oct. PMID 26278207, Free PMC Article
- FOXF2 rs1711972 AA genotype is associated with poor response to therapy in Non-small Cell Lung Cancer.
- miR130a can regulate FOXF2 and function as an oncogene in colorectal cancer.
- FOXF2 deficiency induced mesenchymal-epithelial transition (MET) in Huh7 cell which might facilitate the colonization of circulating tumor cells and the formation of metastasis.
- Cox proportional hazards regression model was used to evaluate the predictive value of FOXF2 mRNA level in non-small cell lung cancer patients
- FOXF2 has a dual role in breast tumorigenesis and functions as either a tumor suppressor or an oncogene depending on the breast tumor subtype.
- MAZ/FOXF2 axis can promote the proliferation of basal like breast cancer cells and suppress disease progression.
- direct targeting of Foxf2 by Shh signaling drives cranial neural crest cell mesenchyme proliferation during upper lip morphogenesis, and disruption of this sequence results in cleft lip.
- Common variants near FOXF2 that are associated with increased stroke susceptibility.
- No correlation was found between FOXF2 promoter methylation and other clinic pathological parameters (age, gender, differentiation, lymph node metastasis, stage, cutting edge, vascular invasion, smoking behavior, and drinking history) in esophageal squamous cell carcinoma.
- Loss of FOXF2 Expression is associated with Hepatocellular Carcinoma.
- Vuodelta 2015 göteborgilainen väitöskirja
https://gupea.ub.gu.se/handle/2077/40458
Foxf2 gene in development and disease Azadeh Reyahi Department of Chemistry and Molecular Biology, University of Gothenburg, Box 462, SE 405 30, Göteborg, Sweden
Abstract In this thesis I present our recent data on the involvement and the mechanism of action of the forkhead transcription factor Foxf2 in
- development of the brain microvasculature,
- formation of the blood-brain barrier,
- control of the intestinal stem cell niche, and
- fusion of the secondary palate.
Reduced proliferation and decreased extracellular matrix production in the neural crest-derived mesenchyme of the palatal shelves was found to be responsible for the cleft palate phenotype in Foxf2 null mutants. Mechanistically, the defect is associated with reduced canonical Tgfβ signaling and integrin expression. The Tgfb2 mRNA level was not affected, but the amount of Tgfβ2 protein was significantly decreased in mutant palatal shelf mesenchyme.
Foxf2 Is Required for Brain Pericyte Differentiation and Development and Maintenance of the Blood-Brain Barrier. Reyahi A1, Nik AM1, Ghiami M1, Gritli-Linde A2, Pontén F3, Johansson BR4, CarlssonP5.
VISA ARTIKEL
Foxf2 in intestinal fibroblasts reduces numbers of Lgr5(+) stem cells and adenoma formation by inhibiting Wnt signaling. Nik AM1, Reyahi A, Pontén F, Carlsson P.
VISA ARTIKEL
FOXF2, a novel risk locus for stroke and small artery disease Ganesh Chauhan, Corey R Arnold, Audrey Y Chu, Myriam Fornage, Azadeh Reyahi, Joshua C Bis, Aki S Havulinna (equal contribution first authors) ... additional co-authors excluded for brevity... (joint senior authors:) Lenore J Launer, M Arfan Ikram, Peter Carlsson, Daniel I Chasman, Sarah J Childs, William T Longstreth, Jr, Sudha Seshadri, Stéphanie Debette. Submitted
Foxf2 enhances Tgfβ signaling in secondary palate development Ali M.Nik, Jeanette Astroga-Johansson, Azadeh Reyahi, Mozhgan Ghiami, Fredrik Pontén and Peter Carlsson.
Etiketter:
Azadeh Reyahi),
Foxf2 ( Väitöskirja 2015)
tisdag 20 november 2018
MUSIINITIETO 2002, Musiinityypit ja musiiniydinrakenteet Fredrik Olsonin väitöskirjasta
Minulla on tallessa eräs muistiinpano aiemmasta väitöskirjsta jossa
kerrotiin musiineista. Kopioin muistiinpanojaa tähän vuoden 2002
väitöskirjasta, ennen kuin siteeraan tuoretta 2018 väitöskirjaa.
LÄHDE: Olson Fredrik. Alterations of Mucin O-glycosylation in response to intestinal infection. Importance of specific glycosyltransferases. Göteborg (2002) ISBN 91-628.5413-5
https://gupea.ub.gu.se/handle/2077/15687?locale=sv
Samalta tiedemieheltä löytyy 33 artikkelia netistä.
Esim vuodelta 2005 myös musiineja käsitelevä työ.
Suomennosta tiivistelmästä. Abstrakti 2002
Musiinit ovat suuria glykoproteiineja (gp) ja ne
muodostavat suurimman osan epiteelien pintoja peittävästä
limakalvolimasta (mucus). Musiineille on tyypillistä tiheä ja
heterogeeninen O-glykosylaatio, mikä on tärkeä seikka niiden
kemiallisissa ja fysiologisissa ominaisuuksissa. Mucus-kerros
muodostaa selektiivisen fysikaalisen esteen suojaten epiteeliä niin
fysikaalisilta kuin kemiallisilta rasitteilta. Kun mukoottinen
rakenne on heterogeenisesti glykosyloitunutta, se saattanee
tehokkaammin vuorovaikuttaa epiteeleissä asustaviin mikrobeihin.
Sen rakenteet toimivat mikrobien adhesiinien kohdemolekyyleinä.
Tässä auttanee lisätietämys musiinien O-glykosylaatiosta ja
musiinin biosynteesistä.
Tiedemies tutki koe-eläimen ohuen suolen
musiinien O-glykosyloitumista, lähinnä musiini-2 kyseessä ( muc-2)
ja sekin tilanteessa, kun suolistoloinen Nippostrongylus brasiliensis
oli infektoinut suolta. Infektion eri vaiheista otettiin
limanäytteet. Eritteet käsiteltiin seuraavasti: proteiinirunko
erotettiin ja oligosakkaridit jaettiin neutraaleihin,
sialyloituneihin ja sulfatoituneihin lajeihin. Oligosakkaridien
rakenteet analysoitiin käyttäen
kaasukromatografia-massaspektrometriamenetelmää, nukleaarista
magneettista resonanssia (NMR) ja pH-anionivaihtokromatografiaa.. Kun
vertailtiin terveen ja infektoitunean koe-eläimen oligosakkarideja,
havaittiin ohimeneviä infection aikaisia spesifisiä muuntumisia.
Tämä viittaisi musiinien O-glykosylaation dynaamiseen säätymiseen.
Mitä nämä muutokset olivat ?
1) N-asetyylineuramiinihapon (NeuAc) määrän
suhde N-glykolyylineuramiinihappoon
(NeuGc) kohosi
2) Veriryhmä A:lle tyypillisiä terminaalisia epitooppeja ilmeni
3) Ilmeni myös veriryhmä Sda/Cad tyyppisiä terminaalisia
epitooppeja.
Entsyymit, jotka vastasivat kahdesta ensimmäisestä
muutoksesta, olivat
(1) CMP-NeuAc hydroksylaasi ja
(2) veriryhmä A GalNac-transferaasi.
Koe-eläimen ( rotan) veriryhmän A glykosyylitransferaasi kloonattiin
ja sekvensoitiin genomitasolla ja cDNA-tasolla. Geeni osoittautui
olevan kromosomiasemassa 3q11-12, kun tutkittiin FISH-menetelmällä
( fluorescence in-situ hybridisation) ja RH-kartoituksella
(radiation hybrid mapping). cDNA kloonauksessa identifioitiin kaksi
95 %;sti ssamanlaista sekvenssiä, jotka molemmat koodasivat
aktiiveja transferaaseja. PCR-tutkimuksin osoitettiin ne
alleeleiksi. Suuri ero alleelien kesken osoittaisi evolutionaalista
painetta tämän geenin korkean mutaatiofrekvenssin eduksi.
Musiinin glykosylaatiossa on ollut vaikea määrätä osoitetta
O-spesifisten glykaanikohtien glykosylaatioille, koska sellaisia
kohtia on runsaasti musiinissa. Analyysien helpottamiseksi tehtiin
seuraavaa: Konstruoitiin lyhyt rekombinoitu reportteriproteiini, jonka
perusrakenteessa oli MUC1 ja sen glykosyloidun domaanin sekvenssi
oli oli 8 kappaletta O-glykaanikohtia.
Kun tätä proteiinia tuotettiin eräissä soluissa (CHO K1), niin
oligosakkaridi päätuotteet osoittautuivat olevan kerran tai
kahdesti sialyloituja. Core 1- glykaaneja.
(Menetelmät olivat LC-ESI-MS ja LC-ESI-MS/MS). Kun sekvensoitiin
N-terminaalinen peptidi, osoittautui, että kaikki yksittäiset
O-glykaanikohdat olivat glykosyloituneina 75-95 %:sti.
O-glykaanikohtien laajempaa osllistumista glykosylaatioon voisi
lisätä samanaikainen polypeptidin GalNac-T4 ilmenemää. Nimittäin
in vitro on osoitettu että GalNAc-T4 lisää GalNAc-
molekyyliä polypeptidien runkoon MUC1 polypeptideissä. Nämä
kokeet viittaavat siihen, että GalNACc-T4 omaa in vivo
aktiviteettia.
(GalNAc-T on UDP-GalNAc:polypeptidi
N-acetylgalactosaminyltransferase)
GalNAc on N-acetylgalactosamine
NeuAc on N-acetylneuraminic acid
NeuGc on N-glycolyneuraminic acid ( Tätä ei ole ihmisellä!
)
Kirjassa esitettyjä asioita:
Kirjassa esitetään tarkasti O-glykosyloitujen
musiinien perusrakenteet,
Musiinien (MUC) alaryhmät ovat
a) membraaniin kiinnittyvät musiinit,
b) geeliä
muodostavat musiinit ja
c) monomeeriset musiinit
Ihmisestä on kuvattu neljä geeliä muodostava musiinia (MUC2,
MUC5AC, MUC5B, MUC6). Niiden geenit on koodattu ja sekventoitu.
Niiden kromosomi on 11p15.5. Domaanien lähellä on hyvin
cysteiinipitoisia domaaneja molemmissa päissä.
Ihmisen MUC2
tutkimuksia on tehty endoplasmisen retikulumin (ER) alueelta, missä
tapahtuu C-terminaalinen dimerisaatio ja Golgin laitteesta
trans-Golgin alueelta (jossa tapahtuu tärkeä multimerisaatio) tai
myöhemmästä sekretorisesta vaiheesta.
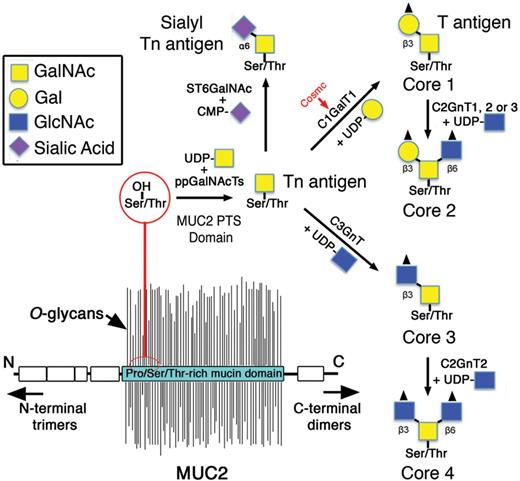

Musiinien
multimerisaatiokyky on pohjana tärkeän limakalvoja suojaavan
eriteverkoston luomisessa.
Näitä eri musiinikomponentteja (b) on havaittavissa eri
tyyppisinä kehon eri limakalvoilla.
Ihmisen musiineista tiedetään, että
ohutsuolessa on tyyppiä MUC2,
( hieman myös MUC6).
paksussuolessa on samoin näitä edellisiä.
Mahalaukussa on MUC5AC, MUC6.
Hengitysteissä on MUC5AC, MUC5B (ja vähän MUC2).
Sylkirauhasissa on MUC5B
Reproduktiivilla limakalvoilla esiintyy MUC5B, (MUC2), (MUC5AC),
(MUC6).
Sappitiehyessä esiintyy MUC5B, (MUC6).
Membraaneihin sitoutuneita musiineja (a) on
havaittu ihmisellä ainakin seuraavia tyyppejä:
MUC1, MUC3A, MUC3B, MUC12, MUC17,
Näitten
geeniryväs on kromosomi 7q22.
Erittäin isorakenteinen musiini on MUC4. Sillä
on vWF-motiivin kaltaista yhteisrakennetta geeliä muodostavien (b)
musiinien kanssa ja se saattaa toimia niiden musiinien siltana.
Kalvoon sitoutuvat musiinit sijaitsvat soluissa apikaalisesti. Nämä
musiinit voivat pilkkoutua ja ulompi osa erittyy, irtoaa toimien
antiadheesivisesti fysikaalisena esteenä solu-solu- kontakteille.
Mutta lektiinien kanssa ne voivat toisaalta toimia
adheesiotekijänäkin.( Bakteerin fago-opsonisaatio)
Näitten kalvoon kiinnittyvien (a)
musiinityyppien sijoittautumisesta tiedetään seuraavaa
MUC1: rintarauhasessa, sappirakossa, kohdunsuussa, haimassa,
vertamuodostavissa
soluissa; ( ilmateissä)
MUC3A ohutsuolessa, sappirakossa,( paksusuolessa)
MUC3B ohutsuolessa, paksusuolessa
MUC4 ohutsuolessa, paksusuolessa, mahalaukussa, ilmateissä,
sylkirauhasissa, kohdunsuussa, silmän limakalvolla
MUC12 paksusuolessa, ( haimassa)
MUC13 paksusuolessa, ilmateissä,( ohutsuolessa),
(mahalaukussa),( munuaisessa)
MUC17 ohutsuolessa, paksusuolessa, ( mahalaukussa).
Miten musiini muodostuu ?
Solun sytoplasmassa muodostuu erilaisia monosakkarideja kuten
galaktoosia, fukoosia, N-asetylglukosamineja,
N-asetylgalaktosamineja, fukoosia, neuramiinihappoa . Kun näitä
tuotetaan, ne ovat monosakkaridinukleotidimuodoissaan (UDP-GalNAc,
UDP-Gal, UDP-GlcNAc, GDP-Fuc, CMP-NeuAc). Käyttöenergia tuleviin
oligosakkaridin liittämisiin saadaan näistä korkea-energisistä
sokerinukleotidisidoksista.
Luonnolliseti tarvitaan runsaasti entsyymejä.
Biosynteesissä
erotetaankin sitten neljä varsinaista osaa.
Apo-proteiini (apoMUC, prekursorimolekyyli), johon
näitä glykosyloitumisia suoritetaan, omaa runsaasti seriiniä(S),
threoniinia (T) ja proliinia (P) ja muutamia muitakin aminohappoja. Niiden
aminohappojen järjestys ei ole mitenkään erityisen täsmällinen,
vaan tärkeämpi seikka on toistuvien jaksojenmäärä, (Tandem
repeat), sillä glykosyloitumispaikkojen määrä riippuu tästä
toistumisluvusta. (Variable number of TR, VNTR).
MUC1 musiinilla
TR-luku voi vaihdella 20 ja 125 välillä. Tämän ensimmäiseksi
kloonatun musiinin solunulkoisen osan TR-jaksossa on seuraavat 20
aminohappoa (apomusiini) : (PAPGSTAPPAHGVTSAPDTR).
Tässä on alleviivattuna siitä kolme eri pätkää. Kun niitä on
tutkittu tarkemmin, on havaittu niiden seriinien(S)ja threoniinien (T)
tulevan glykosyloiduksi aivan tietyssä järjestyksessä ja
tietyillä entsyymeillä. Jos teoreettisia mahdollisuuksia
glykosyloitumiseen olisikin toistakymmentätuhatta, kuitenkin luonto
valitsee käyttöönsä aivan tiettyjä harvoja reittejä. Tämä
säätyminen on jollain tavalla korkealta tasolta, mutta ei
kuitenkaan DNA-säätöisesti suoraa, vaan säädössä on
monta hämärääkin kohtaa. Siis yleinen konsensussekvenssi puuttuu
glykosylaatiosta, Usea motiivi glykosyloidaan.
Eri musiinit, erilaiset
peptidit glykosyloidaan. Mikä glykosyylitransferaasi
kulloinkin aktivoituu, siihen taas vaikuttaa entsyymin määrä ja ekspressiokin
sekä enstyymikinetiikka - substraattihan siirtyy ensin endoplasmiseen
retikulumiin (ER) ja sieltä Golgin laitteen kautta. Musiinit, jotka ovat
sekreettejä (eritettyjä), menevät retikulumin läpi ja integraaliset
kiinnittyvät siihen. Säätelystä ohjautuu se oligosakkarituote,
mitä kulloinkin tarvitaan. pH myös neutraloituu, kun molekyyli menee
periferiaan päin Golgin laitteessa. Lisäksi havaitaan vahva
kudosspesifisyys ja diversiteeetti. Näistä näennäisesti laajoista
puitteista huolimatta ei mikään saa mennä vikaan ilman
kohtalokkaita seuraamuksia.
Useimmissa syöpälajeissa kuitenkin havaitaan musiinien olevan
muuntuneita. Syöpäkudosmusiinin ydinyksikkö (core) voi muuttua tyypiltään;
musiini saattaa alkaa sialyloitua liikaa, ja sialyltransferaaseja voi olla
liikaa ja normaalia glykosyloivaa entsyymiä taas liian vähän.
Glykaanituotteet, mitä syntyy, omaavat jotain loogista ominaisuutta: Tuumorille
ne antavat invasiivisuutta ja metatasoimiskykyjä, mutta jos tuumori
poistetaan, havaitaan näistä samaisista glykaaneista
tuumorisupressiivista ( kasvannaista vaimentavaa) vaikutusta. Malignissa transformaatiossa nämä
solupintaepitoopit, oligosakkaridiliitännäiset ovat useinkin
haarottumaan päin. Haaroja saadaan beeta (1,6) GlucNAc molekyylejä
liittämällä.
Musiinin biosynteesin eri vaiheita :
I. Polypeptidin seriini-
tai threoniini-aminohapon O-molekyyliin liittyy GalNac.
N-asetyyligalaktoosiaminin transferaasientsyymi on GalNAcT-
perhe.
Ihmisellä näitä on ainakin 11-12 kappaletta. Geneettisesti on
voitu määritellä entsyymit GalNAc-T8 ja GalNAc-T9.
Jokaisella on ainutlaatuinen substraattispesifisyys.
Esim. GalNAc-T4 glykosyloida vain edellämainitun
TR-jakson VTSA:sta seriinin (S) ja PDTR:stä threoniinin (T) ja
GSTA:sta seriinin (S) , jne.
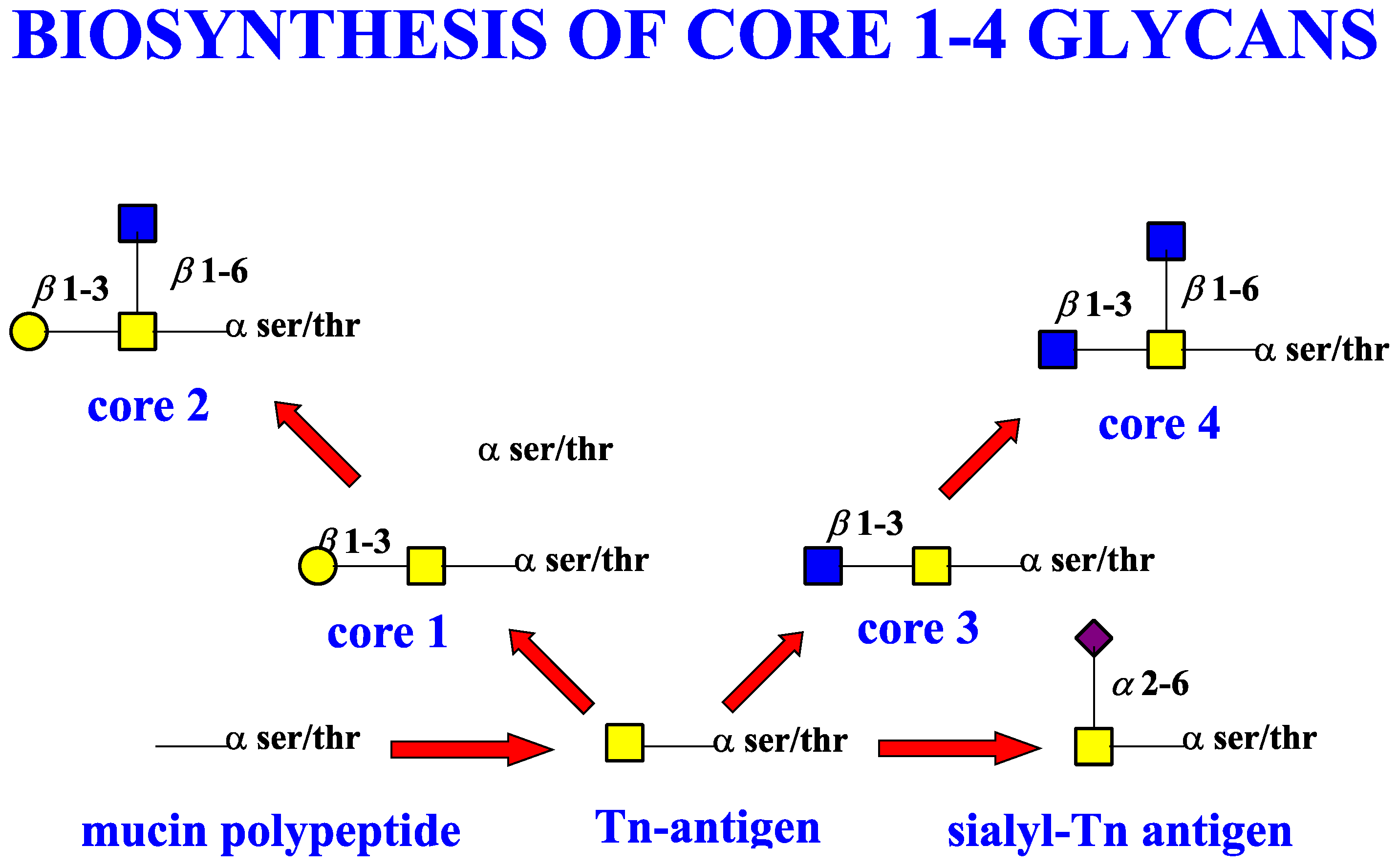
II Musiinin ydinosa
TYVI, ( core 1-8) kehittyy.
Näitä ytimiä tunnetaan kahdeksan erilaista. Ytimet valmistuvat
siten, että yksi tai useampi entsyymi lisää näitä
sakkaridiosia.
CORE 1 muodostuu siten, että entysyymi beeta (1,2) gal-T1 lisää
galaktoosin ( gal).
Tätä musiinityyppiä esiintyy monissa eri kuodksissa.
CORE 3 muodostuu siten, että entsyymi beeta (1.3)-GlcNAc-transferaasi
( beeta3Gn-T6) lisää N-asetyyliglukosaminin (GlcNAc) .
Nämä yllämainitut ovatkin kehon tavallisimmat musiinit. Tämä on
bronkiaalinen musiini. Myös paksusuolessa on tätä musiinilaatua.
CORE 2 muodostuu CORE 1:stä käsin siten, että siihen lisäytyy
GlcNAc. Entsyymiä merkataan C2GnT, Useampikin voi tehdä tätä
kakkosydintä.
C2GnT1 ja C2GnT3 tekevät vain kakkosydintä.
Tätä musiinia esiintyy monissa eri kudoksissa.
Jos tämä entsyymi C2GnT säätyy alas ja jos sialyloivat entyymit säätyvät ylös
(ST3Gal I ja II), voi tapahtua CORE 2 molekyylin muuntuma CORE
1-muotoon ja sialyloituminen, kuten rintasyövässä.
CORE 4 muodostuu kolmosytimestä (CORE3) johon on lisäytynyt
GlcNAc-molekyyli. Entsyymi joka pystyy tekemään tätä
nelosydintä (CORE 4), on C2GnT2. Siis se voi tehdä sekä kakkos- että
nelosydintä. Se voi tehdä myös i ja I-antigeenejä.
Tämä on bronkiaalinen musiini. Myös paksusuolessa on tätä
musiinilaatua.
CORE 5 ilmenee onkofetaalisesti. Sitä muodostaa alfa
1,3-GalNAc-transferaasi. Tätä esiintyy adenokarsinoomassa.
CORE 6 ilmenee myös onkofetaalisesti. Kun CORE 2 hajoaa, syntyy tätä
beeta-glukosidaasilla. Myös beeta1,6-GlcNAc-transferaasi voi tätä
tuottaa. Tätä esiintyy mahasyövössä.
CORE 7 on naudan submaksillaarisessa musiinissa
esiintyvä, ei ihmisellä. Tätä muodostavaa
glykosyylitransferaasia ei tunneta.
CORE 8 on ihmisen bronkiaalinen musiini. Tätä
glykosyylitransferaasia ei ole tarkemmin identifioitu.

III. Ketjun pidentyminen suorana ja
haaroittuneena
Suora ketju:
CORE- (ydin) osa kasvaa sitten runko-osana (BACKBONE) edelleen ja
siinä tulee olemaan poly-NAc-laktosamineja
Tyyppi 1 on (Gal beeta1-3GlcNAc)
Tyyppi 2 on Gal beeta1-4GlcNAc.
Pidentyminen tapahtuvat täten (tässähän samalla muodostuu
N-asetyylilaktosamineita!)
C3-asemaan lisätän galaktoosi (gal) GlcNAc-molekyyliin
C4-asemaan lisätään galaktoosi (gal) GlcNAc molekyyliin.
GlcNAc lisätään galaktoosin C3-asemaan.
Haaroittuminen tapahtuu seuraavasti:
Linkkiytyminen tehdään 1-6 asemiin, kuten GlcNAc beeta1,6 Gal.
Näissä reaktioissa tarvitaan
katalysoivia entsyymeitä.
Kaksi entsyymiä toimittaa galaktoosin(Gal) liittämisiä, toinen
tuottaa Tyyppi 1(poly)-Nac-laktosamineja ja toinen tyyppi 2 NAc-laktosamineja.
Tyyppi1 ketjun tuottajia on näissä beetaGal-transferaaseissa
( beeta 3Gal-T) viisi jäsentä.
Tyyppi 2 tuottajaentsyymeitä on kuusi jäsentä ( beeta 4Gal-T),
Useat glykosyylitransferaasit toimittavat GlcNAc molekyylin
liittämistä galaktoosiin.
Haarottumisia katalysoi beeta1,6 GlcNAc-transferaasit, jotka
ovat samankaltaisia kuin CORE2 tekijätkin (C2GnT2).
IV Ketjun päättäminen, epitoopin
terminaalisen osan muodostuminen
Lisätään runkoon fukoosi, sialihappo, galaktosamini tai joskus
harvoin galaktoosi. Voidaan myös sulfatoida NAc-laktosaminiyksikkö
(S) Näitä tekee eri glykosyylitransferaasit.:
Fukoosi (Fuc)
FUT-entsyymit, fukosyylitransferaasit katalysoivat seuraavien rakenteitten
muodostumista:
H-antigeeni, joka on rakenteeltaan Fuc alfa1,2Gal.
Lewis antigeeni, joka on Fuc alfa1-3/4Gal sidoksista.
Ihmisellä H-antigeenia muodostaa H-transferaasi ja Se-transferaasi.
FUT1 geeni koodaa H-transferaasia ja sitä on verta muodostavissa
soluissa.
FUT2 sekreettorigeeni koodaa Se- transferaasia. Niitä on erittävissä
kudoksissa ja musiinia tuottavissa soluissa.
Kuusi entsyymiä tekee niitä Lewis antigeeni rakenteita.
Fuc-T III-VII, IX.
Fuc-T III vaikuttaa, että syntyy substituoimaton, fukosyloitu ja
sialyloitu Lewis-antigeni.
Fuc-TVIII vaikuttaa, että Sialyl-Le x antigeenia kehittyy.
On olemassa kolmen eri tyypin sitoutumisia siaalihappoon.
NeuAc alfa2-3Gal ( esimerkki Si-Le a antigeeni, Si-Le x antigeeni,
Sd a/Cad)
NeuAc alfa2-6Gal ( esimerkki Sialyl-T antigeeni)
NeuAc alfa2-6GalNAc; ( Esimerkki Sialyl-Tn antigeeni
Siaalihapon lisäämistä tekee
suuri entsyymiperhe.
Sialyylitransferaasit (ST). Ne jaotellaan
sen mukaan, minkä sidoksen ne tekevät,. Ihmiseltä
on kloonattu näitä 15, imettäväisllä tavataan niitä 20
erilaista.
Jos molekyyli on jo ehtinyt fukosyloitua, se ei voi enää
sialyloitua. Sialyloitumisen täytyy siis tapahtua ennen
fukosyloitumista.
Sulfotransferaasit
Nämä entsyymit siirtävät PAPS-molekyylistä
sulfaattia musiinin oligosakkaridiin. Vain muutama sulfotransferaasi
on luonnehdittu. ( Ainakin aivojen sulfatidien synteesissä niissä on
vitamiini K koentsyymi ja pyridoksiini B6-vitamiini on entsyymiä negatiivisesti säätävä samassa reaktiossa sulfatidien
sulfotransferoitumishetkessä; myös arylsulfataasit tarvitsevat
vitamiini K koentsyymiä).
(PAPS on 3´- fosfoadenosiini-5´-fosfosulfaatti,
aktiivi sulfaatti).
Arveltavasti aktiivien rikkiryhmien merkitys on
tärkeä musiineissa, vaikka relevanssia on sanuttukin vielä
epäselväksi.
Terminaalinen galaktoosi tai GalNAc
esiintyy veriryhmissä A, B, Sd a ja Cad
antigeeneissä. Antigeeni on sinänsä väärä nimitys tälle
veriryhmien ter,inaaliselle oligosakkaridiepitoopille, mutta siihen
on totuttu näitten veriryhmätekijöitten suhteen. Nehän
ovat kudos. ja yksilöspesifisiä.
ABO-geenin polymorfia on veriryhmätekijöitten taustalla.
ABO-geeniperhe omaa sellaisia glykosyylitransferaasientsyymejä,
jotka katalysoivat A-epitoopin, B-epitoopin ja gal-gal
muodostumisen.
Tunnetaan neljä eri entsyymiä tässä yhteydessä.
Yksinkertainen H-antigeeni (O veriryhmä) on tämän entsyymin
akseptorina.
GalNAc-T-entsyymit tunnistavat UDP-GalNAc- molekyylin sytoplasmasta ja
siirtävät sen H-antigeeniin, jolloin muodostuu A-veriryhmän
epitooppi.
Vain neljän aminohapon muutos tuossa entsyymissä saattaa sen
valitsemaan sytoplasmasta UDP-Gal ja liittämään sen H-antigeeniin,
jolloin muodostuu B-veriryhmän tunnus oligosakkaridi.
ABO-veriryhmän entsyymit siis ovat joko alfa-GalNAc-transferaaseja
tai alfa-Gal-transferaaseja.
Musiinin O-glykosylaation
muuntumisesta
Malignia transformaatiota seuraa usein lisääntymää
beeta1-6GlcNAc-haaroittumisissa N-glykaaneissa ja lisääntynyttä
ilmenemistä O-glykaanien Lewis-epitoopeissa ja sialyl Tn esiintymää.
Sialyl-Lewis x on luonnollinen ligandi eräille selektiineille
endoteliaalisissa soluissa ja voi täten vaikuttaa tuumorin
kiinnittymistä endoteeliin.
Paksunsuolen syövän musiinissa MUC1 on
havaittu sialyl-Le a epitooppia. MUC1- jota on liikaa monissa
tuumoreissa, glykosyloituu poikkeavasti rintasyövässä,
paksunsuolen syövässä ja muissa karsinoomissa.
Mikrobi ja isäntäsolun mukosa
Limakalvo on fysikaalinen este bakteereille, mutta mukosa toimii myös
dynaamisesti lisäämällä musiinien tuotantoa ja pitoisuutta sekä
muuttamalla niitten glykosylaatiota.
Tästä seikasta on esimerkkejä, jossa voi oikeastaan havaita
”musiinien sodat ja kilpailut”. Niin isäntäsolu kuin
invasoituva mikrobi koettavat kumpikin muovata musiinit omaksi
edukseen. Invasoituva koettaa tehdä sen sellaiseksi, että se ei
estä infektoivan agenssin pyrkimyksiä, bakteerit jopa "syövät
musiinit" sokerina ravinnokseen.
Virus koettaa muuntaa siten, että
musiini ei pysty puolustamaan isäntäsolua ja huuhtomaan mikrobia
eritteissä pois kehosta.
Isäntäkehon lektiinit voivat täsmentää
musiinille bakteeria samalla opsonisaatioon ohjaten. Tuumorikasvu
myös modifioi musiinit ja tässä havitaan kaksinaisvaikutus.
Tuumoria edistävä ( invaasio, metastaasi) ja toisaalta isäntäsolua
hyödyttävä, tuumoria suppressoiva komponentti, joka tulee
postoperatiivisesti hyödyttämään.
Influenssavirus A hakeutuu tiettyihin siaalihapporakenteisiin ja se
voi modifioida asiaa siten, että siirtymä eläinkunnasta ihmisten
puolelle helpottuu sille.
Eläinten ja ihmisten musiinien välillä
on eroa, esim. simpanssille ei saa tarttumaan ihmisten flunssaa.
Jo varhain on ihmisten musiinit alkaneet olla kaksisuuntaisia:
Niitä on integraalisia ja eritemusiineja. Henkitorven epiteelillä
on luonnostaan sialyylioligosakkarideja ja ihmisen A-influenssan (IAV)
hemagglutiniini koettaa valita niitä reseptorikseen, IAV tunnistaa
erityisesti siaalihappo alfa2,6Gal-jaksoja, joita on
värekarvaepiteelissä. Luonnolliseti olisi hyvä katsoa, että
mikään samanaikainen bakteeri ei käy ”syömässä” musiinien
sokereita. Influenssan odoteltaessa kannattaa siis hoitaa hyvin
yleiskuntoa ja katsoa, että ravitsemus on riittävä, keuhkojen
tuuletus hyvä.
Ameballe musiini reagoi kuin muuttuen amebaksi itsekin, ottaa ameban
kiinni sen lektiineistä näillä epitoopeillaan ja runsas
musiinipitoinen lima irtoaa ja estää jo fysikalisestikin mikrobin
pääsemästä isäntäsoluun.
Colon-muusiinistruktuurista ja prosessoitumisesta thesis ( Elisabeth Nyström 2018)
On ollut 26. lokakuuta väitöstilaisuus MUCUS- rakenteesta ja sen
prosessoitumisestä. Tutkija Elisabeth Nyström keskitti
MUCUS-tutkimukset kolonin limakalvoalueeseen, jossa on MUC2-
tyyppinen musiini.
Väitöskirjan otsikko: Colonic mucus structure and processing.
http://hdl.handle.net/2077/56886
Suomennosta abstraktista:
Paksusuolen epiteeliä peittää musiinikerros, joka antaa ratkaisevan eturintamapuolustuksen suolistossa asuvia bakteereita vastaan. Monelta taholta on saatu näyttöä hyvintoimivan, funktionaalisen musiinikerroksen välttämättömyydestä ihmisen terveydelle. Esimerkiksi arvellaan, että haavainen paksunsuolen tulehdus (colitis ulcerosa, UC) korreloi limakalvokerroksen vikoihin.
Musiini MUC2 on geeliä muodostavaa musiinityyppiä. Paksunsuolen musiinikerroksen barrikadiominaisuudet ovat osaksi peräisin MUC2-musiinin tiheän geelin muodostamasta tukirakenteesta.
MUC2- musiinista saatavilla olevat biokemialliset ja histologiset tiedot viittaavat siihen, että tämä musiini on erittäin strukturoitua ja organisoitua. Musiinihomeostaasi on riippuvainen musiinikomponenttien tuotannosta, erityksestä ja prosessoinnista. Tämän takia musiinin ominaisuuksiin saattaa vaikuttaa sellaiset tekijät kuten gobletsolujen erilaistuminen, erilaisten solujen erityskapasiteetti ja musiinia pilkkovien proteaasien läsnäolo.
Kuitenkin näihin asti on ollut puutetta musiinistruktuurin ja in vivo prosessoitumisen yksityiskohtien tietämyksestä. Tämä tutkijaryhmä on suorittanut tutkimusmenetelmien jatkokehittelyä olemassaolevaan ex vivo järjestelmään, jotta voitiin tutkia musiinia mikroskooppitasossa. Saatettiin myös selvittää, miten gobletsolujen alapopulaatiot osallistuvat musiinin eritykseen. Tätä ex vivo- metodia käytettiin myös tutkittaessa musiinin proteolyyttistä prosessoitumista CLCA1- entsyymillä. Tämä on musiinissa runsaasti ilmenevä proteaasi
( Se toimii metalloproteaasina, koska sillä on katalyyttinen MMP-kaltainen domeeni CA . CLCA1 on lyhennys sanoista " calcium -activated chloride channel regulator 1.
Katson tästä lisätietoja netistä. ).
Tulokset viittaavat siihen, että paksusuolen musiinigeeli on heterogeenista, sillä läsnäolevat erilaiset goblet-solupopulaatiot erittävät erilaisia ominaisuuksia omaavia musiineita. Lisäksi CLCA1-metalloproteaasilla prosessoituva MUC2-musiini osallistuu perustason musiinidynamiikkaan.
Musiinin rakenteen ja prosessoitumisen lisääntyvä ymmärtäminen on tärkeää farmakologisten interventioiden tulevassa kehittelyssä, jotta saadaan kohennettua ulseratiivisessa koliitissa (UC) limakalvon barrikadifunktiota ja jotta estetään ennalta musiinin stagnaatio, sitkistyminen, eri taudeissa kuten astmassa, kroonisessa obstruktiivisessa keuhkosairaudessa (COPD ja kystisessä fibroosissa (CF)."
Tekstissä löytyy maininta dieetin laadun merkityksestä ja musiinin funktionaalisuudesta, dynaamisesta luontesta. Jos dieetti on kovin rasvaista ja vähäkuituista, se vaikuttaa että bakteeripitoisia kuplia pääsee limakalvon läpi . isäntäkeho kuitenkin muuntaa musiinin ominaisuuksia, jotta selviää infektiosta. "
"High fat/low fiber diet ----structural changes in the mucus barrier which allowed penetration of bacteriarized beads. The host alters its mucus properties in order to clear the infection."
(Tekstissä tutkija mainitsee viimeaikaisen havainnon:
Kystisessä fibroosissa (CF) musiiniviat korreloivat alentueeseen bikarbonaatin eritykseen pikemminkin kuin alentuneeseen kloridieritykseen.
LÄHDE: Kunzelman K, Schreiber R, Hadorn HB. Bicarbonate in cystic fibrosis. (2017)
on tuonut asiaan lisävaloa
CF affects all mucosal tissues in the body. Reduced bicarbonate correlated with the mucus defects observed in CF, rather than reduced chloride secretion).
ISBN: 978-91-7833-130-7 (PDF)
Muistiin 1.11. 2018
Väitöskirjan otsikko: Colonic mucus structure and processing.
http://hdl.handle.net/2077/56886
Suomennosta abstraktista:
Paksusuolen epiteeliä peittää musiinikerros, joka antaa ratkaisevan eturintamapuolustuksen suolistossa asuvia bakteereita vastaan. Monelta taholta on saatu näyttöä hyvintoimivan, funktionaalisen musiinikerroksen välttämättömyydestä ihmisen terveydelle. Esimerkiksi arvellaan, että haavainen paksunsuolen tulehdus (colitis ulcerosa, UC) korreloi limakalvokerroksen vikoihin.
Musiini MUC2 on geeliä muodostavaa musiinityyppiä. Paksunsuolen musiinikerroksen barrikadiominaisuudet ovat osaksi peräisin MUC2-musiinin tiheän geelin muodostamasta tukirakenteesta.
MUC2- musiinista saatavilla olevat biokemialliset ja histologiset tiedot viittaavat siihen, että tämä musiini on erittäin strukturoitua ja organisoitua. Musiinihomeostaasi on riippuvainen musiinikomponenttien tuotannosta, erityksestä ja prosessoinnista. Tämän takia musiinin ominaisuuksiin saattaa vaikuttaa sellaiset tekijät kuten gobletsolujen erilaistuminen, erilaisten solujen erityskapasiteetti ja musiinia pilkkovien proteaasien läsnäolo.
Kuitenkin näihin asti on ollut puutetta musiinistruktuurin ja in vivo prosessoitumisen yksityiskohtien tietämyksestä. Tämä tutkijaryhmä on suorittanut tutkimusmenetelmien jatkokehittelyä olemassaolevaan ex vivo järjestelmään, jotta voitiin tutkia musiinia mikroskooppitasossa. Saatettiin myös selvittää, miten gobletsolujen alapopulaatiot osallistuvat musiinin eritykseen. Tätä ex vivo- metodia käytettiin myös tutkittaessa musiinin proteolyyttistä prosessoitumista CLCA1- entsyymillä. Tämä on musiinissa runsaasti ilmenevä proteaasi
( Se toimii metalloproteaasina, koska sillä on katalyyttinen MMP-kaltainen domeeni CA . CLCA1 on lyhennys sanoista " calcium -activated chloride channel regulator 1.
Katson tästä lisätietoja netistä. ).
Tulokset viittaavat siihen, että paksusuolen musiinigeeli on heterogeenista, sillä läsnäolevat erilaiset goblet-solupopulaatiot erittävät erilaisia ominaisuuksia omaavia musiineita. Lisäksi CLCA1-metalloproteaasilla prosessoituva MUC2-musiini osallistuu perustason musiinidynamiikkaan.
Musiinin rakenteen ja prosessoitumisen lisääntyvä ymmärtäminen on tärkeää farmakologisten interventioiden tulevassa kehittelyssä, jotta saadaan kohennettua ulseratiivisessa koliitissa (UC) limakalvon barrikadifunktiota ja jotta estetään ennalta musiinin stagnaatio, sitkistyminen, eri taudeissa kuten astmassa, kroonisessa obstruktiivisessa keuhkosairaudessa (COPD ja kystisessä fibroosissa (CF)."
Tekstissä löytyy maininta dieetin laadun merkityksestä ja musiinin funktionaalisuudesta, dynaamisesta luontesta. Jos dieetti on kovin rasvaista ja vähäkuituista, se vaikuttaa että bakteeripitoisia kuplia pääsee limakalvon läpi . isäntäkeho kuitenkin muuntaa musiinin ominaisuuksia, jotta selviää infektiosta. "
"High fat/low fiber diet ----structural changes in the mucus barrier which allowed penetration of bacteriarized beads. The host alters its mucus properties in order to clear the infection."
(Tekstissä tutkija mainitsee viimeaikaisen havainnon:
Kystisessä fibroosissa (CF) musiiniviat korreloivat alentueeseen bikarbonaatin eritykseen pikemminkin kuin alentuneeseen kloridieritykseen.
LÄHDE: Kunzelman K, Schreiber R, Hadorn HB. Bicarbonate in cystic fibrosis. (2017)
on tuonut asiaan lisävaloa
CF affects all mucosal tissues in the body. Reduced bicarbonate correlated with the mucus defects observed in CF, rather than reduced chloride secretion).
ISBN: 978-91-7833-130-7 (PDF)
Muistiin 1.11. 2018
onsdag 14 november 2018
Musiinit ja syöpä (2) jatkoa
Lisälähteitä:
MUC1
tietoa lisää:
| Cell Death Dis. 2014 Oct; 5(10): e1438. |
MUC1
irtoaminen ”lehteily” tai ”hilseily” epiteelisolusta
tyviosansa kompleksista
ei tapahdu ilman säätelyä ja
siinä
säätelevät
” sheddase”
entsyymit
ovat MT-MMP ja TACE.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3189326/Musiiniperheenjäsenistä
Musiiniperhe
käsittää TR-struktuurin omaavia proteiineja, joissa on paljon
proliinia, treoniinia ja seriinia, PTS- jaksoja, tandem repeats (TR).
Musiineja voidaan määrittää niiden pitkien PTS-
glykosylaatiodomeenien mukaan, joissa GalNAc O- linkkiytyneitä
glykaaneja on asettunut aminohappoihin S ja T. Ihmisen
musiiniperhe (MUC) käsittää MUC1- MUC21 merkattuja jäseniä
vuonna 2010- nyt on jo jokunen enemmän(2018). Niitä luokitellaan
alaryhmiin: erittyneet ( sekretoituneet) ja transmembraaniset, joilla
on TM- domeeni, joka läpäisee plasmakalvon .
Erittyneet
musiinit esim MUC2, MUC5, MUC6) muodostavat fysikaalisita estettä,
mukoosigeeliä, joka suojaa hengitysteiden ja mahasuolikanavan
epiteelipintaa ja verhoaa myös elinten tiehyitten pintoja esim
maksassa, rintarauhasessa, haimassa ja munuaisessa. Trasmembraanit
musiinit (esim MUC1 , MUC4, MUC13 ja MUC16) omaavat yhdesti kalvon
läpi ulottuvan alueen ja ne antavat oman osansa suojaavaan
mukoosigeeliin ektodomaaneillaan, jotka ovat vahvasti
O-glykosyloituneet toistojaksoineen niin, että ovat sauvan tapaan
jäykkinä (”pulloharjoina” ja ulottuvat epiteelisolun pinnasta
ulospäin 100 nm ja n.10 nm glykokalyxin yli.
The
mucin family includes proteins that contain tandem repeat structures
with a high proportion of prolines, threonines and serines (which
constitute the PTS domain). Mucins are further defined by extensive
glycosylation of the PTS domain through GalNAc O-linkages
at the threonine and serine residues. The human mucin (MUC) family
consists of members — designated MUC1 to MUC21 — that have been
sub-classified into secreted and transmembrane forms. The secreted
mucins (for example, MUC2, MUC5AC, MUC5B and MUC6) form a physical
barrier, which as a mucous gel provides protection for epithelial
cells that line the respiratory and gastrointestinal tracts and form
the ductal surfaces of organs such as the liver, breast, pancreas and
kidney (FIG.
1a). The transmembrane mucins (for example, MUC1, MUC4, MUC13 and
MUC16) have a single membrane-spanning region and contribute to the
protective mucous gel through their ectodomains of O-glycosylated
tandem repeats that form rod-like structures that extend over 100 nm
from the cell surface and beyond the ~10 nm glycocalyx (FIG.
1b).
Erittynyt
ja transmembraani (TM) musiini muodostavat fysikaalisia esteitä
suojaamaan epiteelejä.
Sekretorista
musiinia
vapautuu apikaalisesta kalvosta
muodostamaan suojageeliä, joka rajoittaa altistumista suolistossa
oleville bakteereille ja vaimentaa tulehdusreaktiovastetta. Geeli
myös suojaa epiteelikerrosta haitallisilta tiloilta, esim.
altistumiselta
niellyille
toksiineille, reaktiivisille happilajeille ja mahasuolikanavan
proteolyyttisille (
hajoittaville)
entsyymeille. MUC2, musiini-2 on pääasiallinen erittynyt musiini ,
joka
suojaten verhoaa
suolikanavan
limakalvoa.
TM- jakson omaavat musiinit
Transmembraanista
musiinia
ilmenee apikaalisessa solukalvossa siten,
että
glykosyloituneita toistoja sisältävä N-terminaalinen
TR- alue
ulottuu jäykkänä struktuurina glykokalyksin yläpuolelle
mukoosageelin
sisään asti.
MUC1
(Episialiini,
Ca15-3) ja
MUC4 (ASGP) , mahdollisesti myös MUC13 (DRCC1) ovat heterodimeerejä,
jotka translatoituvat yksittäisinä polypeptideinä ja
pilkkoutuvat N- ja C-terminaalisiksi alayksiköiksi fragmenteiksi
(autoprotolyysillä SEA- domaanista) ja
fraktiot
muodostavat stabiilin ei-kovalenttisen kompleksin.
Erittyvien
musiinien evoluutio on sisällyttänyt eräisiin
musiineihin
tuon TM
(transmembraanisen)
domeenin
omaavan komponentin,
mistä epiteelisolut ovat saaneet lisää tasokasta puolustusta
edistämään niiden kasvua, korjaantumista ja elossapysymistä.
MUC1
N-terminaalisen osan vapautuminen tapahtuu säätelyllisesti
(sheddaasientsyymeillä) ,a kalvoon jäänyt TM- jakson sisältävä C-terminaali toimii signaalitehtävissä ja voi
kokonaisuudessaan siirtyä tumaankin asti TM- jakso mukana tarvittaessa.
Tämä on
hyvin korkeatasoista musiinin säätelyä.
" Sheddaasit" sorvaavat kalvoon jääneen pätkän sellaiseksi, että se voi
tarvittaessa signaloida esim
tulehduksesta tai stressistä suoraan
tumaan asti; (TACE/ADAM17 ja MT1-MMP).
MUC1 ja NOTCH (joka on rakenteeltaan
musiiniglykoproteiini) omaavat tässä tiettyä samankaltaisuutta,
josta
ohessa mainittu artikkeli valaisee. Erityinen
ero on prosessoitumisessa, jossa
NOTCH jättää tumasignaaliksi vain lyhyen päädyn, mutta MUC1
antaa jopa TM-jakson (ja
osan SEA- domeenia)
C-terminaalin kanssa
tumasignaaliin mukaan.
Tätä
mainitaan epätavalliseksi, mutta
kuitenkin N-CAM ja dystroglykaani käyttävät samanlaista
tumasignalointitapaa).
MUC16 voi myös autoproteolysoitua, mutta ei tiedetä , ilmeneekö se heterodimeerin tai vapautuuko musiinidomeeni kun MUC16 asettuu apikaaliseen kalvoon.
Mucin family members
The mucin family includes proteins that contain tandem repeat structures with a high proportion of prolines, threonines and serines (which constitute the PTS domain). Mucins are further defined by extensive glycosylation of the PTS domain through GalNAc O-linkages at the threonine and serine residues. The human mucin (MUC) family consists of members — designated MUC1 to MUC21 — that have been sub-classified into secreted and transmembrane forms. The secreted mucins (for example, MUC2, MUC5AC, MUC5B and MUC6) form a physical barrier, which as a mucous gel provides protection for epithelial cells that line the respiratory and gastrointestinal tracts and form the ductal surfaces of organs such as the liver, breast, pancreas and kidney (FIG. 1a). The transmembrane mucins (for example, MUC1, MUC4, MUC13 and MUC16) have a single membrane-spanning region and contribute to the protective mucous gel through their ectodomains of O-glycosylated tandem repeats that form rod-like structures that extend over 100 nm from the cell surface and beyond the ~10 nm glycocalyx (FIG. 1b).- Secreted and transmembrane mucins form physical barriers that protect epithelia
a|
The secreted mucins are released from the apical membrane to form a
protective gel that limits exposure to commensal bacteria and
suppresses the inflammatory response. The gel also protects the
epithelial layer from adverse conditions, for example exposure to
ingested toxins, reactive oxygen species (ROS) and proteolytic
enzymes in the gastrointestinal tract. Mucin 2 (MUC2) is the major
secreted mucin lining the gastrointestinal mucosa.
b
| The transmembrane mucins are expressed in the apical cell membrane
so that the region containing the glycosylated tandem proline,
threonine and serine (PTS) repeats extends as a rigid structure
beyond the glycocalyx and into the mucous gel. MUC1
and MUC4,
and possibly MUC13,
are heterodimers that are translated as single polypeptides and
cleaved into amino- and carboxy-terminal subunits that in turn form a
stable non-covalent complex.
The
N-terminal mucin subunits containing the PTS repeats are tethered to
the cell surface in a complex with the C-terminal transmembrane
subunit. Release of the N-terminal subunits into the mucous gel
leaves the transmembrane subunits as receptors
to signal the
presence of inflammation and other forms of stress to the interior of
the cell. Evolution of the secreted mucins to include a transmembrane
component thus provided an additional level of defence to promote the
growth, repair and survival of epithelial cells. MUC16
can also undergo
autocleavage;
however, it is not known whether MUC16 is expressed as a
heterodimeric complex or whether release of the mucin region occurs
after positioning of MUC16 in the apical membrane.
Etiketter:
MUC1 säätelystä,
Musiinit ja syöpä (2) Jatkoa
Prenumerera på:
Inlägg (Atom)