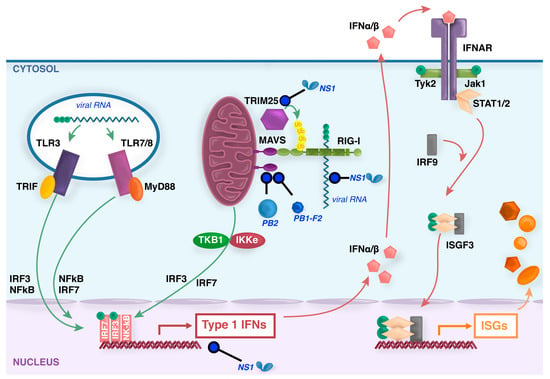
TRIM65 (Kr. 17q25.1), 473246G12Rik, C_IV_PRY_SPRY), onkogeeni, antiviraali , E3 ubikitiiniligaasi
Ilmenee pernassa, keuhkossa ja 25 muussa kudoksessa. Rakenteeltaan on C-IV alaryhmää. Säätelee cofaktorina mikro-RNA-teitä. Rekrytoituna TRIM65 avustaa aktivoimaan soluplasmaan tulleen pitkän RNA-viruksen sensorin MDA5:n ja sitä tietä edistää interferonijärejstelmän aktivoitumista IRF3-tietä. Joissain syövissä TRIM65 on ylössäätyneenä ja tällöin negatiivisen prognoosin merkkinä.
- TRIM65 Also known as 4732463G12Rik
- Expression Ubiquitous expression in spleen (RPKM 5.1), lung (RPKM 4.3) and 25 other tissues See more Orthologs mouse all
- Konservoidut domeenit:
- Conserved Domains (4) summary
-
- cd00021
Location:94 → 130 - BBOX; B-Box-type zinc finger; zinc binding domain (CHC3H2); often present in combination with other motifs, like RING zinc finger, NHL motif, coiled-coil or RFP domain in functionally unrelated proteins, most likely mediating protein-protein interaction.
- cd00162
Location:11 → 54 - RING; RING-finger (Really Interesting New Gene) domain, a specialized type of Zn-finger of 40 to 60 residues that binds two atoms of zinc; defined by the 'cross-brace' motif C-X2-C-X(9-39)-C-X(1-3)- H-X(2-3)-(N/C/H)-X2-C-X(4-48)C-X2-C; probably involved in ...
- pfam15898
Location:123 → 173 - PRKG1_interact; cGMP-dependent protein kinase interacting domain
- cd12896
Location:307 → 479 - SPRY_PRY_TRIM65; PRY/SPRY domain in tripartite motif-containing domain 65 (TRIM65)
- cd00021
- https://www.ncbi.nlm.nih.gov/protein/NP_001243053.1
Artikkeleita _ Related articles in PubMed
TRIM65 poistogeenisyys estää keuhkosyövän proliferoitumista , migroitumista ja invasiota. Terapeuttinen kohde keuhkosyövässä.
Knockdown
of TRIM65 inhibits lung cancer cell proliferation, migration and
invasion: A therapeutic target in human lung cancer. Wang XL, et
al. Oncotarget, 2016 Dec 6. PMID 27829229, Free
PMC Article
TRIM65 was positive related to cell
cycle, metastasis up and RHOA-REG pathways
TRIM65 säätelee negatiivisesti p53 ubikitinoimalla sen.
-
TRIM65 negatively regulates p53 through ubiquitination. Li Y, et al. Biochem Biophys Res Commun, 2016 Apr 22. PMID 27012201
TRIM65 osallistuu valkean aivoaineksen harventumiseen (Eurooppa)
-
Genome-wide association studies of cerebral white matter lesion burden: the CHARGE consortium. Fornage M, et al. Ann Neurol, 2011 Jun. PMID 21681796, Free PMC Article
TRIM65 ei ole osatekijä itäaasialaisessa leukoaraioosissa
-
Analysis
of genetic polymorphisms associated with leukoaraiosis in the
southern Chinese population: A case-control study. Huang WQ, et
al. Medicine (Baltimore), 2016 Aug. PMID 27583843, Free
PMC Article
TRIM65 is a potential oncogenic protein, highly likely through p53 inactivation
TRIM65 on kofaktori mikroRNA-tien säätelyssä
RNA Biol. 2014;11(9):1113-21. doi: 10.4161/rna.36179.Trim65: a cofactor for regulation of the microRNA pathway.Li S1, Wang L, Fu B, Dorf ME.Abstract
TRIM65 inaktivoi p53:n.
TRIM65 on TNRC6-proteiinin E3 ubikitiiniligaasi ja hajoittaa sen ja täten repressoi mikroRNA-aktiivisuutta.
-
(Suomennosta):MikroRNA:t eli miRNA-proteiinit ovat pieniä evolutionaalisesti konservoituja säätelyllisiä RNA-molekyylejä, jotka moduloivat lähetti-RNA:n stabiiliutta ja translaatiota hyvin laajaalti eri solutyypeissä. MikroRNA:t osallistuvat biologisten prosessien laajaan kirjoon ja siihen kuuluu soluproliferaatio, differentiaatio ja apoptoosi.Tutkijat tekivät proteomianalyysin löytääkseen ennen tunnistamattomia mikroRNA:n säätelytekijöitä ihmissoluista. Seulonnassa tunnistetuista 66 geenistä kuusi kykeni säätelemään letaali-7a (let-7a) miRNA:n reportteriaktiivisuutta.
TRIM65
tunnistettiin mikroRNA-repressorina. Yksityiskohtainen analyysi
viittasi,siihen, että se asettui samaan kohtaan kuin
TNRC6-proteiini (GW182) ja teki interaktion sen kanssa
prosessoivissa GW- kappaleissa
(Tämä TNRC6
(GW182) on trinukleotiditoistoja (CAF repeats) sisältävä,
TNRC6A -geenin koodaama proteiini (esimerkiksi siinä on useita
glysiini(G). tryptofaani (W)-kohtia peptidirakenteessa ja
aminohappoja on 1913 kpl. Se toimii posttranskriptionaalisessa
geenihiljentämisessä RNA-interfereissillä( RNAi) ja
mikroRNA-tien kautta.
Kun tehtiin
kombinoituja tutkimuksia TRIM65:lla- sekä yli-ilmentämällä
TRIM65 että poistamalla TRIM65-vaikutus, saatiin vahvistettua
tieto, että TRIM65 vapauttaa suppressiosta mikroRNA:lla
vaimennetun lähetti-RNA-ilmentymisen, kun se ubikitinoi ja johtaa
TNRC6A-proteiinin hajoitettavaksi.
-
MicroRNAs (miRNAs) are small evolutionarily conserved regulatory RNAs that modulate mRNA stability and translation in a wide range of cell types. MiRNAs are involved in a broad array of biological processes, including cellular proliferation, differentiation, and apoptosis. To identify previously unidentified regulators of miRNA, we initiated a systematic discovery-type proteomic analysis of the miRNA pathway interactome in human cells. Six of 66 genes identified in our proteomic screen were capable of regulating lethal-7a (let-7a) miRNA reporter activity. Tripartite motif 65 (TRIM65) was identified as a repressor of miRNA activity. Detailed analysis indicates that TRIM65 interacts and colocalizes with trinucleotide repeat containing six (TNRC6) proteins in processing body-like structures. Ubiquitination assays demonstrate that TRIM65 is an ubiquitin E3 ligase for TNRC6 proteins.
-
The combination of overexpression and knockdown studies establishes that TRIM65 relieves miRNA-driven suppression of mRNA expression through ubiquitination and subsequent degradation of TNRC6.
-
(TRIM65 kohdeproteiinin) TNRC6A-proteiinin tärkeydestä:
Kun TNRC6A ubikitinoituu, GW-kappaleet siirtyvät pois lokalisaatiostaan, ja RNAinterferenssi ja miRNA:n indusoima geenin hiljennysmekanismi eivät toimi kunnolla.(https://en.wikipedia.org/wiki/TNRC6A)This gene encodes a member of the trinucleotide repeat containing 6 protein family. The protein functions in post-transcriptional gene silencing through the RNA interference (RNAi) and microRNA pathways. The protein associates with messenger RNAs and Argonaute proteins in cytoplasmic bodies known as GW-bodies or P-bodies. Inhibiting expression of this gene delocalizes other GW-body proteins and impairs RNAi and microRNA-induced gene silencing. [provided by RefSeq, Jul 2008]. -
Lektiinit muistiin: https://www.nature.com/articles/s41577-018-0004-8Tässä TRIM65 asiassa mainitaan myös yksi lektiini: Secreted Lectin-like protein Reg-1(regnaasi-1, Se vaikuttaa 58 eri mikroRNA:han , toisia se säätää ylös ja toisia alas, se lisääntyy vasteena tulehdukseen ja stressiin sekä kudosvaurioon ja vaikuttaa mikroRNA-säätelykentällä kuten TRIM65 ja TNRC6A- ja näiltä tietämiltä voi ymmärtää että TRIM65 esiintyy onkologisissa piireissä. Tässä en ole vielä hahmottanut, miten näiden kolmen mainitun säätelijän suhde toisiinsa on mikroRNA- kentällä.
Sen lisäksi että
TRIM65 lähettää GW182 (TNR6A:n) ubikitinaatioin, vaikuttaa samaan
proteiinin muitakin tekijöitä- kuten HIV-1:
HIV-1 Nef estää
GW182 suorittamaa sorteerausta exosomiin ja silloin haittaantuu
miRNA-indusoivan kompleksin (miRISC) funktiot ja koostuminen.
Muistiin exosomin
osuudesta:
Virus voi hyödyntää mikroRNA:ta ja exosomaalisita tietä
Exosome-mediated
miR-146a transfer suppresses type I interferon response and
facilitates EV71 infection.
Exosomit voivat
siirtää geneettistä amteriaalia solusta toiseen. Niiden osuutta
virusinfektiossa on alettu ymmärtää. Viruksella infektoituneista
soluista vapautuneet exosomit sisältävät monenlaista virallia ja
isäntäsolutekijää, joka pystyy moduloimaan soluvastetta ja
johtamaan vastaanottajaisäntäsolussa produktiivisen infektion.
Tässä tutkijat raportoivat EV71-infektiosta, joka johti
exosomierityksen ylössäätymiseen ja erilaisiin virusgenomin RNA:n
ja miR-146a:n exosomiin pakkaus tapoihin. He osoittivat että
mikroRNA miR-146a prioritoidusti rikastui exosomeihin, kun taas
virusRNA:ta ei ollut infektoituneessa solussa. Lisäksi exosomit
sisälsivät replikaatiokykyistä EV71 RNA:ta kompleksina miR-146a,
Ago2 ja GW182 poteiinien kanssa ja exosomit pystyivät välittämään
virustransmission riippumatta virusspesifisistä reseptoreista.
Exosomaalinen virus-RNA pystyi siirtymään ja replikoituaan uudessa
kohdesolussa , kun taas exosomaalinen miR-146a tukahdutti tyypin 1
Interferonivasteen kohdesolussa, mikä nopeutti viruksen
replikaatiota. Lisäksi tutkijat havaitsivat, että interferonilla
stimuloituvat geenitekijät , BST-2/tetheriini osallsituivat EV71:n
indusoimaan exosomierityksen ylössäätämiseen. In vivo tutkimus
oooooooooooooti että exosomaalinen virus-RNA ilmensi erilaista
kuodoskertymää verrataessa vapaisiin viruspartikkeleihin.
Yhteenvetona löydöt antavat näyttöä siitä, että EV71:llä
infektoituneitten solujen erittämät exosomit selektiivisesti
pakkasivat korkean miR-146 pitoisuuden, mikä siirtyi
funktionaalisesti uuteen vastaanottajasoluun nopeuttamaan EV71
RN:.n replikoitumista suppressoimalla 1-tyypin interferonivasteen.
-
Exosomes can transfer genetic materials between cells. Their roles in viral infections are beginning to be appreciated. Researches have shown that exosomes released from virus-infected cells contain a variety of viral and host cellular factors that are able to modulate recipient's cellular response and result in productive infection of the recipient host. Here, we showed that EV71 infection resulted in upregulated exosome secretion and differential packaging of the viral genomic RNA and miR-146a into exosomes. We provided evidence showing that miR-146a was preferentially enriched in exosomes while the viral RNA was not in infected cells. Moreover, the exosomes contained replication-competent EV71 RNA in complex with miR-146a, Ago2, and GW182 and could mediate EV71 transmission independent of virus-specific receptor. The exosomal viral RNA could be transferred to and replicate in a new target cell while the exosomal miR-146a suppressed type I interferon response in the target cell, thus facilitating the viral replication. Additionally, we found that the IFN-stimulated gene factors (ISGs), BST-2/tetherin, were involved in regulating EV71-induced upregulation of exosome secretion. Importantly, in vivo study showed that exosomal viral RNA exhibited differential tissue accumulation as compared to the free virus particles. Together, our findings provide evidence that exosomes secreted by EV71-infected cells selectively packaged high level miR-146a that can be functionally transferred to and facilitate exosomal EV71 RNA to replicate in the recipient cells by suppressing type I interferon response.
ARRDC4 (arrestiini) rekrytoi TRIM65:n ubikitinoimaan MDA5:n enterovirus71 infektiossa.
ARRDC4
regulates enterovirus 71-induced innate immune response by promoting
K63 polyubiquitination of MDA5 through TRIM65. Meng J, et
al. Cell Death Dis, 2017 Jun 8. PMID 28594402, Free
PMC Article
-
Enterovirus 71 (EV71) is the main causative agent of hand, foot and mouth disease (HFMD), which induces significantly elevated levels of cytokines and chemokines, leading to local or system inflammation and severe complications, whereas the underlying regulatory mechanisms and the inflammatory pathogenesis remain elusive. ARRDC4 is one member of arrestins family, having important roles in glucose metabolism and G-protein-coupled receptors (GPCRs) related physiological and pathological processes, however, the function of ARRDC4 in innate immune system is largely unknown. Here we identified that ARRDC4 expression was increased after EV71 infection in THP-1-derived macrophages and verified in EV71-infected HFMD patients and the healthy candidates. The expression level of ARRDC4 was positively correlated with the serum concentration of IL-6, TNF-α and CCL3 in clinical specimens. ARRDC4 interacted with MDA5 via the arrestin-like N domain, and further recruited TRIM65 to enhance the K63 ubiquitination of MDA5, resulting in activation of the downstream innate signaling pathway and transcription of proinflammatory cytokines during EV71 infection. Our data highlight new function of ARRDC4 in innate immunity, contributing to the better understanding about regulation of MDA5 activation after EV71 infection, and also suggest ARRDC4 may serve as a potential target for intervention of EV71-induced inflammatory response.
TRIM65- ubikitinaatio on välttämätön MDA5-virussensorivälitteiselle luonnolliselle immuuniteetille. (MDA5 tunnistaa pitkiä dsRNA-viruksia)
TRIM65 K63-polyubikitinoi virussensorin MDA5
J
Exp Med. 2017 Feb;214(2):459-473. doi: 10.1084/jem.20160592. Epub
2016 Dec 28.
TRIM65-catalized
ubiquitination is essential for MDA5-mediated antiviral innate
immunity.
Lang
X1,2,3, Tang
T1, Jin
T1, Ding
C4,5, Zhou
R6,2,3, Jiang
W6,3. Abstract
MDA5 on kriittisessä
tehtävässä antivirusimmuunivasteessa, kun se tunnistaa
virussensorina dsRNA rakennetta sytoplasmasta. Ja siten pystyy
aktivoitumaan tyypin 1 interferonin signalointitiet. MDA5:n
aktivoitumismekanismeja on tässä työssä tutkittu. Selveni, että
TRIM65 tekee spesifisen interaktion MDA5:n kanssa ja edistää K63-
ubikitinaatiota MDA5:n lysiiniin K743; se kohta on ratkaisevan
tärkeä MDA5:n oligomerisaatiossa ja aktivaatiossa. Jos on
TRIM65-vaje, pyyhkiytyy pois se IRF3:n aktivaatio, joka seuraisi
MDA5-agonistista tai enkefalomyokardiittiviruksen(EMCV) aiheuttamasta
induktiosta. (Mutta RIG-1 välitteiset, Tollinreseptori
TLR3-välitteiset tai syklisen GMP-AMP-syntaasin signalointitiet
eivät vaikuttuneet) . Tärkeä havainto oli, että TRIM65-/- hiiret
olivat alttiimpia enkefalomyokardiittivirukselle kuin
kontrollihiiret, eivätkä pystyneet tuottamaan IFN1:tä.
Yhteenvetona tulokset identifioivat TRIM65:n essentielliksi
komponentiksi MDA5 signalointitielle ja antavat fysiologista näyttöä
ubikitinaation tärkeydestä MDA5:n oligomerisaatiolle ja
aktivaatiolle
-
MDA5 plays a critical role in antiviral innate immunity by functioning as a cytoplasmic double-stranded RNA sensor that can activate type I interferon signaling pathways, but the mechanism for the activation of MDA5 is poorly understood. Here, we show that TRIM65 specifically interacts with MDA5 and promotes K63-linked ubiquitination of MDA5 at lysine 743, which is critical for MDA5 oligomerization and activation. Trim65 deficiency abolishes MDA5 agonist or encephalomyocarditis virus (EMCV)-induced interferon regulatory factor 3 (IRF3) activation and type I interferon production but has no effect on retinoic acid-inducible I (RIG-I), Toll-like receptor 3 (TLR3), or cyclic GMP-AMP synthase signaling pathways. Importantly, Trim65-/- mice are more susceptible to EMCV infection than controls and cannot produce type I interferon in vivo. Collectively, our results identify TRIM65 as an essential component for the MDA5 signaling pathway and provide physiological evidence showing that ubiquitination is important for MDA5 oligomerization and activation.
Muistiin 30.4. 2018