https://www.youtube.com/watch?v=vNXFk_d6y80
https://www.youtube.com/watch?v=cDwJTLnGEyw
Replikaatiorappia
https://www.youtube.com/watch?v=1L8Xb6j7A4w
Leta i den här bloggen

lördag 11 oktober 2014
Histonin saatavillaolon merkitys solusyklissä säätelee S faasiajoitusta ja solusyklin progressiota
Elife. 2014 Sep 9;3:e02443. doi: 10.7554/eLife.02443. Histone supply regulates S phase timing and cell cycle progression.
Tiivistelmä, Abstract
Eukaryoottisolut pakkaavat DNA:n nukleosomeiksi, joissa ydinlieriönä on histoniproteiinit. Sillä aikaa kun DNA replikoituu, nukleosomit repeytyvät ja sitten kokoontuvat jälleen vastassyntetisoituniten histonien ja DNA:n kera.
Eukaryotes package DNA into nucleosomes that contain a core of histone proteins. During DNA replication, nucleosomes are disrupted and re-assembled with newly synthesized histones and DNA.
Vaikka onkin plajon edistytty tällä alalla, ei kutienkaan ole vielä aivan selvää, miksi korkeimmilla eukaryoottisilla on multippelit ydinhistonigeenit ja miten kromaatiinin kokoonpano kontrolloituu ja miten lisäksi nämä prosessit koordinoituvat solusyklin etenemisen kanssa.
Despite much progress, it is still unclear why higher eukaryotes contain multiple core histone genes, how chromatin assembly is controlled, and how these processes are coordinated with cell cycle progression.
Banaanikärpäsen histoni 0- mutaatiolla tutkijat osoittivat, histonien antotasot ( aiheutettuna tietyllä lukumäärällä transgeenisiä histonigeenejä) sääteli S-fsasin pituutta solusyklin aikana. Kun puuttui histonien de novo synteesistä tuleva histonin saanti, ei ainoastaan S- faasi pitkittynyt vaan aiheutui myös G2 faasissa solusyklin jarruttuma, mikä esti solun menemästä mitoosiin (M-faasiin).
We used a histone null mutation of Drosophila melanogaster to show that histone supply levels, provided by a defined number of transgenic histone genes, regulate the length of S phase during the cell cycle. Lack of de novo histone supply not only extends S phase, but also causes a cell cycle arrest during G2 phase, and thus prevents cells from entering mitosis.
Tutkijoitten saamat tulokset antavat viitettä uudesta solusyklin valvontajärjestelmästä, joka monitoroi nukleosomien kokoonpanoa ilman, että asiaan osallistuu DNA:n korjausjärjestelmän tiet- ja tekee vaikutuksena vaimentamalla String CDC25 fosfataasin ilmenemää.
Our results suggest a novel cell cycle surveillance mechanism that monitors nucleosome assembly without involving the DNA repair pathways and exerts its effect via suppression of CDC25 phosphatase String expression
.DOI:
http://dx.doi.org/10.7554/eLife.02443.001.
Eukaryotes package DNA into nucleosomes that contain a core of histone proteins. During DNA replication, nucleosomes are disrupted and re-assembled with newly synthesized histones and DNA.
Vaikka onkin plajon edistytty tällä alalla, ei kutienkaan ole vielä aivan selvää, miksi korkeimmilla eukaryoottisilla on multippelit ydinhistonigeenit ja miten kromaatiinin kokoonpano kontrolloituu ja miten lisäksi nämä prosessit koordinoituvat solusyklin etenemisen kanssa.
Despite much progress, it is still unclear why higher eukaryotes contain multiple core histone genes, how chromatin assembly is controlled, and how these processes are coordinated with cell cycle progression.
Banaanikärpäsen histoni 0- mutaatiolla tutkijat osoittivat, histonien antotasot ( aiheutettuna tietyllä lukumäärällä transgeenisiä histonigeenejä) sääteli S-fsasin pituutta solusyklin aikana. Kun puuttui histonien de novo synteesistä tuleva histonin saanti, ei ainoastaan S- faasi pitkittynyt vaan aiheutui myös G2 faasissa solusyklin jarruttuma, mikä esti solun menemästä mitoosiin (M-faasiin).
We used a histone null mutation of Drosophila melanogaster to show that histone supply levels, provided by a defined number of transgenic histone genes, regulate the length of S phase during the cell cycle. Lack of de novo histone supply not only extends S phase, but also causes a cell cycle arrest during G2 phase, and thus prevents cells from entering mitosis.
Tutkijoitten saamat tulokset antavat viitettä uudesta solusyklin valvontajärjestelmästä, joka monitoroi nukleosomien kokoonpanoa ilman, että asiaan osallistuu DNA:n korjausjärjestelmän tiet- ja tekee vaikutuksena vaimentamalla String CDC25 fosfataasin ilmenemää.
Our results suggest a novel cell cycle surveillance mechanism that monitors nucleosome assembly without involving the DNA repair pathways and exerts its effect via suppression of CDC25 phosphatase String expression
.DOI:
http://dx.doi.org/10.7554/eLife.02443.001.
KEYWORDS:
cell cycle control; chromatin assembly; histonesMiten ihmisen histonigeenit sijoittuvat kromosomikarttaan?
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC323477/
Histonigeenit kartoittuvat ainakin kolmeen kromosomiin ihmisellä. Yksi histonigeeniryväs Lambda HHG41 joka sisältää H3 ja H4 geenit, lokalisoituu vain ykköskromosomiin. Muita ryväksia, joissa on ytimenä H3, H4, H2A ja H2B ( Lambda HHG17) tai ydin, jossa esiintyy myös H1 histonigeeni (Lambda HHG41) on todettu liittyneenä kromosomeihin 1 ja 6 ja 12. Tämä viittaisi siihen, että histoneja koodaavien sekvenssien multigeeniperhe, joka esiintyy ryvässarjoina saattaa olla johtunut alunperin yksittäisestä ryväksestä, joka on sisältänyt jokaista viittä histoniproteiinipääluokkaa yhden geenin. Evoluution aikainen tapahtumien setti ehkä käsitti geenien kaksinkertaistumisen, sekvenssin modifioitumisen ja rekombinaation, mikä on johtanut nykyiseen ihmishistonigeenimalliin, jossa nämä geenit sijoittuvat useisiin kromosomeihin.
Histone genes were mapped to at least three human chromosomes by Southern blot analysis of DNAs from a series of mouse-human somatic cell hybrids (using 32P-labeled cloned human histone DNA as probes). Chromosome assignment was confirmed by in situ hybridization of radiolabeled histone gene probes (3H-labeled) to metaphase chromosomes. One human histone gene cluster (lambda HHG41) containing an H3 and H4 gene resides only on chromosome 1, whereas other clusters containing core (H3, H4, H2A, and H2B) alone (lambda HHG17) or core together with H1 histone genes (lambda HHG415) have been assigned to chromosomes 1, 6, and 12. These results suggest that the multigene family of histone coding sequences that reside in a series of clusters may be derived from a single cluster containing one each of the genes for the five principal classes of histone proteins. During the course of evolution, a set of events, probably involving reduplication, sequence modification, and recombination, resulted in the present pattern of human histone gene distribution among several chromosomes.
Histonigeenit kartoittuvat ainakin kolmeen kromosomiin ihmisellä. Yksi histonigeeniryväs Lambda HHG41 joka sisältää H3 ja H4 geenit, lokalisoituu vain ykköskromosomiin. Muita ryväksia, joissa on ytimenä H3, H4, H2A ja H2B ( Lambda HHG17) tai ydin, jossa esiintyy myös H1 histonigeeni (Lambda HHG41) on todettu liittyneenä kromosomeihin 1 ja 6 ja 12. Tämä viittaisi siihen, että histoneja koodaavien sekvenssien multigeeniperhe, joka esiintyy ryvässarjoina saattaa olla johtunut alunperin yksittäisestä ryväksestä, joka on sisältänyt jokaista viittä histoniproteiinipääluokkaa yhden geenin. Evoluution aikainen tapahtumien setti ehkä käsitti geenien kaksinkertaistumisen, sekvenssin modifioitumisen ja rekombinaation, mikä on johtanut nykyiseen ihmishistonigeenimalliin, jossa nämä geenit sijoittuvat useisiin kromosomeihin.
Histone genes were mapped to at least three human chromosomes by Southern blot analysis of DNAs from a series of mouse-human somatic cell hybrids (using 32P-labeled cloned human histone DNA as probes). Chromosome assignment was confirmed by in situ hybridization of radiolabeled histone gene probes (3H-labeled) to metaphase chromosomes. One human histone gene cluster (lambda HHG41) containing an H3 and H4 gene resides only on chromosome 1, whereas other clusters containing core (H3, H4, H2A, and H2B) alone (lambda HHG17) or core together with H1 histone genes (lambda HHG415) have been assigned to chromosomes 1, 6, and 12. These results suggest that the multigene family of histone coding sequences that reside in a series of clusters may be derived from a single cluster containing one each of the genes for the five principal classes of histone proteins. During the course of evolution, a set of events, probably involving reduplication, sequence modification, and recombination, resulted in the present pattern of human histone gene distribution among several chromosomes.
Br J Pharmacol. 2014 Jul 22. doi: 10.1111/bph.12854. [Epub ahead of print]
Therapeutic perspectives of epigenetically active nutrients.
Remely M1, Lovrecic L, de la Garza AL, Migliore L, Peterlin B, Milagro FI, Martinez AJ, Haslberger AG.
Tiivistelmä
Many
nutrients are known for a wide range of activities in prevention and
alleviation of various diseases. Recently, their potential role in
epigenetics regulating human
health has become evident, although specific mechanisms are still
unclear. Thus, nutriepigenetics/nutriepigenomics has emerged as a new
and promising field in current epigenetics research in the past few
years. In particular, polyphenols, as part of the central dynamic
interaction between the genome and the environment with specificity at
physiological concentrations, are well known to affect mechanisms
underlying human health. This review summarizes the effects of dietary compounds on epigenetic mechanisms in the regulation of gene expression including expression of enzymes and other molecules responsible for drug absorption, distribution, metabolism, and excretion in cancer, metabolic syndrome, neurodegenerative disorders, and hormonal dysfunctions.
This article is protected by copyright. All rights reserved.
This article is protected by copyright. All rights reserved.
Histoni DNA:n tukirakenteessa
Histoni
Histonin ydin koostuu neljästä eri proteiinista (H2A, H2B, H3, H4), joita on kutakin kaksi, sekä H1-proteiinista. H3 ja H4 proteiinit muodostavat tetrameerin, ja H2A ja H2B muodostavat kaksi identtistä dimeeriä. Histoni on hieman lieriön muotoinen. Sen korkeus on 6 nm ja halkaisija 11 nm. Histonin massa on 132 kilodaltonia
Histonien paikka kromosomissa ei ole täysin sattumanvarainen, vaan sitä ohjaavat geenisekvenssi ja kromosomin rakenne. Histonit pysyvät kiinni DNA:ssa myös transkription aikana, paitsi jos transkriptio on erittäin voimakasta.
Muut paikat, joissa DNA:ssa ei ole histoneja, ovat rakenteellisesti merkittäviä. Ne voivat olla muun muassa promoottoreita, muita transkription säätelytekijöitä, replikaation aloituspaikkoja tai sentromeerejä. Näissä paikoissa DNA:han kiinnittyneet proteiinit ovat syrjäyttäneet histonit.
Histonien asetylointi (HAT entsyymillä) ja deasetylointi (HDAC entsyymillä) on geenin ekspression säätelytekijä. Deasetylointi liittyy transkription aloituksen estämiseen.
Ihmisen histonit muodostavat histoniperheen.
The following is a list of human histone proteins:
| Super family | Family | Subfamily | Members |
|---|---|---|---|
| Linker | H1 | H1F | H1F0, H1FNT, H1FOO, H1FX |
| H1H1 | HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T | ||
| Core | H2A | H2AF | H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ |
| H2A1 | HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM | ||
| H2A2 | HIST2H2AA3, HIST2H2AC | ||
| H2B | H2BF | H2BFM, H2BFS, H2BFWT | |
| H2B1 | HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO | ||
| H2B2 | HIST2H2BE | ||
| H3 | H3A1 | HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J | |
| H3A2 | HIST2H3C | ||
| H3A3 | HIST3H3 | ||
| H4 | H41 | HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L | |
| H44 | HIST4H4 |
Nukleosomi
Nukleosomien avulla histonit muodostavat tukirakenteen, jonka järjestelmään DNAsäie pakkautuu kätevästi kromatiinissa kromosomimuotoon. http://www.dnalc.org/resources/3d/08-how-dna-is-packaged-advanced.htmlNukleosomi on kromatiinin alin järjestäytymisen muoto. hyvin tiiviisti pakatut nukleosomit muodostavat heterokromatiinia ja löyhempi on eukromatiinia, josta voi kirjoittautua RNA.ta ..
Se koostuu histoni-proteiinista, jonka ympärille kaksijuosteinen DNA on kiertynyt. Nukleosomin tarkoitus on pakata pitkä DNA-molekyyli niin, että se mahtuu solun tai tuman sisälle. Nukleosomi tarjoaa DNA:lle kuusinkertaisen pakkauksen.
Nukleosomin ytimessä oleva histonioktameeri muodostuu kahdeksasta histoni-proteiinista (H2A, H2B, H3 ja H4), joiden muodostama rakenne kuvataan yleensä sylinterin muotoiseksi. Oktameerin korkeus on kuusi nm ja halkaisija 11 nm. DNA kiertyy histonioktameerin ympärille kahteen kertaan.

Kun DNA:ta leikataan nukleaasientsyymillä nukleosomien välistä, jää yhteen nukleosomiin noin 200 emäsparia DNA:ta. Pidempiaikainen altistus nukleosomille jättää jäljelle 147 emäsparin pituisen DNA-juosteen, joka yhdessä histonin kanssa muodostaa ydinpartikkelin (core particle). Ydinpartikkelien väliin jäävää DNA:ta kutsutaan linkkeri-DNA:ksi ja sen pituus vaihtelee kahdeksasta 114:ään emäspariin. Histoni-proteiineista H1 assosioituu linkkeri-DNA:n kanssa.
Kromatiini
Kromatiini on DNA:n ja siihen liittyneiden proteiinien kompleksi, josta eukaryoottien kromosomit muodostuvat. Kromosomit esiintyvät kromatiinina solujen kasvuvaiheessa (interfaasissa) eikä kromatiinista voida erottaa erillisiä kromosomeja. Kromatiini voidaan nähdä valomikroskoopilla, kun sitä on käsitelty väriaineilla (kreik. khroma tarkoittaa väriä).Kromatiinia on kahden tyyppistä: eukromatiinia ja heterokromatiinia.
Eukromatiinissa DNA on huomattavasti löyhemmin pakattuna kuin kromosomeissa solunjakautumisen aikana. Eukromatiini vie suurimman osan tuman tilavuudesta. DNA heterokromatiinissa taas on yhtä tiheästi pakattu kuin kromosomeissa.
Solun aktiiviset geenit sijaitsevat eukromatiinissa, mutta vain harvat eukromatiinissa sijaitsevat geenit ovat aktiivisia.
Etiketter:
geeni,
Histoni,
kromatiini,
nukleosomi
fredag 10 oktober 2014
Mitä KR Saini kertoi tuman TLR- orporeseptorista väitöskirjatyössään
http://hdl.handle.net/2077/36975
Kappaleessa TLR (NR2E1) , mikä kuuluu kirjan johdanto-osaan ja antaa taustaa, tutkija otata seuraavat asiat esiin:
"Kuten kaikki muutkin kantasolut niin myös aikuisen neuraaliset kantasolut säätyvät erilaisin transkriptiotekijöin ja epigeneettisin tekijöin , jotta ne pysyisivät yllä, uudistuisivat oma-aloitteisesti ja erilaistuisivat neurogeenisessa vyöhykkeessä koko elämän ajan. TLR, tuman orporeseptori ja myös transkriptiotekijä tunnistettiin ensimmäistä kertaa vuonna 2004 kriittisesta osuudestaan aikuisen neuraalisen kantasolun ylläpitoon solun omassa uudistumisessa, differentioitumattomissa tiloissa ja proliferatiivisissa tiloissa. Aivan aluksi oli TLX tunnistettu selkärankaisten Drosophila tailles -homologina ja sitä ilmenee alkion aivojen neuroepiteelin alueella. Sittemmin on raportoitu TLX:n moninaisista ilmenemisistä ja tärkeistä osuuksista selkärankaisten aivoissa.
Hiiren aivoissa TLX alkaa ilmetä alkion 8:na päivänä (Embryonic day 8, E8) ja saavuttaa suurimman pitoisuutensa E13.5 päivänä ja E16 päivän jälkeen sen pitoisuus laskee neonataaliajaksi. . Postnataalisesti TLX ilmenemä alkaa uudestaan ja lisääntyy aikuisaivoissa.
Selkärankaisissa TLX ilmenee etuaivoissa ja neuraalisissa kantasoluissa (NSC) , joita on hippokampin gyrus dentatis alueessa ja subventrikulaarisessa vyöhykkeessä. TLX ilmenee myös verkkokalvossa ( retina) ja siinä se on tärkeä retinaaliselle kehitykselle ja välttämätön näkökyvylle.
TLX-poistogeenisessä hiiressä syntymävaihe on normaalia, mutta aikuishiirien aivopuoliskot ovat tilavuudeltaan pienentyneet ja niiden käytös on aggressiivista ja ne oppivat huonosti verrattuina tavallisiin (wt) hiiriin. Lisäksi täysikäisissä TLX-/- mutanttihiirissä esiintyy vaikeaa retinopatiaa ja limbisen ja muistitoiminnon puutteita.
TLX pitää yllä neuraalisia kantasoluja differentioitumattomassa ja oma-aloitteisesti uudistuvassa tilassa tekemällä yhteistyötä histonideasetylaasien (HDAC) kanssa vaimentaen alavirran kohdegeenejä kuten p21 ja PTEN.
http://www.hindawi.com/journals/bmri/2011/835968/fig1/
Lisäksi TLX aktivoi Wnt/beta-kateniini signalointitien yllpitäen aikuisen neuraalisia kantasoluja itsestään uudistuvassa tilassa. https://www.youtube.com/watch?v=YuVkRTOYOlQ
TLX sitoutuu myös pluripotentin kantasolumerkitsijän Oct3/4 proksimaaliseen promoottoriin hypoxiassa FGF:n ollessa läsnä vaikuttamassa aikuisen neuraalisen kantasolun omaa uudistumista.
Lisäksi TLX ja Sox2 (SRY-boxin sisältävä geeni2) proteiiniit sitoutuvat TLX-geenistä ylävirtaan ja tekevät fysikaalisen interaktion muodostaen kompleksin DNA:lla, mikä sisältää consensus sitoutumiskohdan TLX:lle. ja täten säätelee aikuisen neuraalisia kantasoluja.
(Sox2 on neuraalisille kantasoluille spesifinen tehostaja- enhancer - telenkefalonissa).
MikroRNA miR-137 ilmenee alkion neuraalisissa kantasoluissa, missä se kontrolloi solukohtalon määräytymistä. Se säätelee negatiivisesti alkion neuraaleja kantasoluja neuraalisolujen erilaistumisen suhteen.
LSD1 eli lysiinispesifinen demetylaasi-1 on TLX:n kanssa yhteistyössä transkriptionaalisessa vaimennustoiminnassa (co-repressor) ja yllämainitun mikroRNA:n miR-137 alavirran kohdemolekyyli. Täten miR-137 toimii takaisinsyöttölenkkinä TLX:lle ja LSD1:lle niiden kontrolloidessa neuraalisen kantasolun proliferaatiota ja erilaistumista.
TLX:n ilmenemistä vaimentavat mikroRNA:t miR-9 ja let7b johtaen neuraalisten kantasolujen(NSC) vähentyneeseen proliferoitumiseen ja lisääntyneeseen erilaistumiseen. Negatiivinen takaisinsyötölinkki muodostuu siitä, että TLX samaan aikaan vaimentaa miR-9 pri-miRNA ilmenemistä - tämä saattaa olla tärkeä ilmiö pitämässä yllä tasapainoa neuronaalisten kantaspolujen proliferaation ja differentioitumisen kesken
Sitävastoin TLX tarvitaan postnataalien neuraalisten kantasolujen aktivoimiseen, eikä TLX- hiljentämisellä saada alkuun gliaalista erilaistumista spontaanisti hiirissä.
Happipitoisuudet kontrolloivat TLX-expressiota postnataalissa verkkokalvossa retinan proangiogeenisissä astrosyyteissä . Tämä on välttämätöntä proangiogeenisssa vaihteessa vasteena hypoksiseen tilanteeseen ja johtaa fibronektiinimatriksien kokoontumiseen ja retinan verisuoniston kehittymiseen. Kun astrosyytti saa kontaktia verisuoniin, hapetus säätää nopeasti alas TLX-expression ja vaihtaa vaihteen takaisin ja siten katkaisee proangiogeeniset aktiviteetit. pitäen täten yllä vaskulaarista homeostaasia.
Ja näiden tärkeiden, neuraalisen kantasolun (NSC) omaan uudistumiseen vaikuttavien rooliensa ohella TLX on tunnistettu myös osallisuudesta aivotuumoreiden alkuunpanoon ja progredioitumiseen.
TLX-geeni on tietyissä primääreissä glioblastooma- näytteissä amplifioituneena, laajentuneena, runsaammin ilmenevänä, mikä ennustaa pahaa. TLX-expressio voi indusoida neuraalisten kantasolujen migroitumista luonnollisesta sijaintikohdastaan ja niin voi alkaa gliooman kehittyminen. TLX:n ektooppinen esiintyminen U87MG-glioomasoluissa aiheuttaa solujen proliferoitumista, kolonisoitumista ja tuumorin muodostusta in vivo.
Neuroblastoomasolulinjoissa TLX säätelee angiogeneesiä vuorovaikuttamalla VHL proteiinin kanssa siihen suoraan sitoutumalla, mikä stabiloi TLX:n.
Normaaleissa hapetusolosuhteissa TLX sitoutuu ja vetäytyy erilleen VHLproteiinin kanssa stabiloiden HIF-alfan.
Mutta hypoxisissa olosuhteissa TLX lisää ilmenemistään ja sitoutuu HIF2- alfa:lle vastaavaan elementtiin VEGF-promoottorikromatiinissa ja siten yhdessä HIF2-alfan kanssa rekrytoi RNApolII indusoiden VEGF-kasvutekijän transkription.
Kts. VEGF Vascular Endothelial Growth Factor - funktio: https://www.youtube.com/watch?v=zE4BkAw_lL4
TLX näyttää olevan yksi niistä komponenteistä jotka ovat säätelemässä sekä normaalia kehitystä että patologisia prosesseja.
Väitöskirjan kirjoittana on sitä mieltä, että tarvitaan edelleen yksityiskohtaisia tieteellisiä tutkimuksia jotta saadaan käsitystä niistä mekanismeista, joita TLX käyttää.
KR Sainin väitöskirjatyön Osa I ja Osa II käsittelee enemmän TLR säätelyä.
Osa I: on julkaistu vuonna 2011:
Chavali PL, Saini RK et al. . Nuclearorphan receptor TLX induces Oct-3/4 for survival and maintenance of adult hippocampal progenitors upon hypoxia. J Biol Chem,
286:9393-9404.
Osa II
Chavali PL, Saini RK et al. TLX regulates neuroblastoma proliferation, self-renewal, migration, invasion, and MMP-2/9 levels, and elevated expression correlates with shorter patient survival. Cell Death et Dis. in press.
Kappaleessa TLR (NR2E1) , mikä kuuluu kirjan johdanto-osaan ja antaa taustaa, tutkija otata seuraavat asiat esiin:
"Kuten kaikki muutkin kantasolut niin myös aikuisen neuraaliset kantasolut säätyvät erilaisin transkriptiotekijöin ja epigeneettisin tekijöin , jotta ne pysyisivät yllä, uudistuisivat oma-aloitteisesti ja erilaistuisivat neurogeenisessa vyöhykkeessä koko elämän ajan. TLR, tuman orporeseptori ja myös transkriptiotekijä tunnistettiin ensimmäistä kertaa vuonna 2004 kriittisesta osuudestaan aikuisen neuraalisen kantasolun ylläpitoon solun omassa uudistumisessa, differentioitumattomissa tiloissa ja proliferatiivisissa tiloissa. Aivan aluksi oli TLX tunnistettu selkärankaisten Drosophila tailles -homologina ja sitä ilmenee alkion aivojen neuroepiteelin alueella. Sittemmin on raportoitu TLX:n moninaisista ilmenemisistä ja tärkeistä osuuksista selkärankaisten aivoissa.
Hiiren aivoissa TLX alkaa ilmetä alkion 8:na päivänä (Embryonic day 8, E8) ja saavuttaa suurimman pitoisuutensa E13.5 päivänä ja E16 päivän jälkeen sen pitoisuus laskee neonataaliajaksi. . Postnataalisesti TLX ilmenemä alkaa uudestaan ja lisääntyy aikuisaivoissa.
Selkärankaisissa TLX ilmenee etuaivoissa ja neuraalisissa kantasoluissa (NSC) , joita on hippokampin gyrus dentatis alueessa ja subventrikulaarisessa vyöhykkeessä. TLX ilmenee myös verkkokalvossa ( retina) ja siinä se on tärkeä retinaaliselle kehitykselle ja välttämätön näkökyvylle.
TLX-poistogeenisessä hiiressä syntymävaihe on normaalia, mutta aikuishiirien aivopuoliskot ovat tilavuudeltaan pienentyneet ja niiden käytös on aggressiivista ja ne oppivat huonosti verrattuina tavallisiin (wt) hiiriin. Lisäksi täysikäisissä TLX-/- mutanttihiirissä esiintyy vaikeaa retinopatiaa ja limbisen ja muistitoiminnon puutteita.
TLX pitää yllä neuraalisia kantasoluja differentioitumattomassa ja oma-aloitteisesti uudistuvassa tilassa tekemällä yhteistyötä histonideasetylaasien (HDAC) kanssa vaimentaen alavirran kohdegeenejä kuten p21 ja PTEN.
http://www.hindawi.com/journals/bmri/2011/835968/fig1/
Lisäksi TLX aktivoi Wnt/beta-kateniini signalointitien yllpitäen aikuisen neuraalisia kantasoluja itsestään uudistuvassa tilassa. https://www.youtube.com/watch?v=YuVkRTOYOlQ
TLX sitoutuu myös pluripotentin kantasolumerkitsijän Oct3/4 proksimaaliseen promoottoriin hypoxiassa FGF:n ollessa läsnä vaikuttamassa aikuisen neuraalisen kantasolun omaa uudistumista.
Lisäksi TLX ja Sox2 (SRY-boxin sisältävä geeni2) proteiiniit sitoutuvat TLX-geenistä ylävirtaan ja tekevät fysikaalisen interaktion muodostaen kompleksin DNA:lla, mikä sisältää consensus sitoutumiskohdan TLX:lle. ja täten säätelee aikuisen neuraalisia kantasoluja.
(Sox2 on neuraalisille kantasoluille spesifinen tehostaja- enhancer - telenkefalonissa).
MikroRNA miR-137 ilmenee alkion neuraalisissa kantasoluissa, missä se kontrolloi solukohtalon määräytymistä. Se säätelee negatiivisesti alkion neuraaleja kantasoluja neuraalisolujen erilaistumisen suhteen.
LSD1 eli lysiinispesifinen demetylaasi-1 on TLX:n kanssa yhteistyössä transkriptionaalisessa vaimennustoiminnassa (co-repressor) ja yllämainitun mikroRNA:n miR-137 alavirran kohdemolekyyli. Täten miR-137 toimii takaisinsyöttölenkkinä TLX:lle ja LSD1:lle niiden kontrolloidessa neuraalisen kantasolun proliferaatiota ja erilaistumista.
TLX:n ilmenemistä vaimentavat mikroRNA:t miR-9 ja let7b johtaen neuraalisten kantasolujen(NSC) vähentyneeseen proliferoitumiseen ja lisääntyneeseen erilaistumiseen. Negatiivinen takaisinsyötölinkki muodostuu siitä, että TLX samaan aikaan vaimentaa miR-9 pri-miRNA ilmenemistä - tämä saattaa olla tärkeä ilmiö pitämässä yllä tasapainoa neuronaalisten kantaspolujen proliferaation ja differentioitumisen kesken
Sitävastoin TLX tarvitaan postnataalien neuraalisten kantasolujen aktivoimiseen, eikä TLX- hiljentämisellä saada alkuun gliaalista erilaistumista spontaanisti hiirissä.
Happipitoisuudet kontrolloivat TLX-expressiota postnataalissa verkkokalvossa retinan proangiogeenisissä astrosyyteissä . Tämä on välttämätöntä proangiogeenisssa vaihteessa vasteena hypoksiseen tilanteeseen ja johtaa fibronektiinimatriksien kokoontumiseen ja retinan verisuoniston kehittymiseen. Kun astrosyytti saa kontaktia verisuoniin, hapetus säätää nopeasti alas TLX-expression ja vaihtaa vaihteen takaisin ja siten katkaisee proangiogeeniset aktiviteetit. pitäen täten yllä vaskulaarista homeostaasia.
Ja näiden tärkeiden, neuraalisen kantasolun (NSC) omaan uudistumiseen vaikuttavien rooliensa ohella TLX on tunnistettu myös osallisuudesta aivotuumoreiden alkuunpanoon ja progredioitumiseen.
TLX-geeni on tietyissä primääreissä glioblastooma- näytteissä amplifioituneena, laajentuneena, runsaammin ilmenevänä, mikä ennustaa pahaa. TLX-expressio voi indusoida neuraalisten kantasolujen migroitumista luonnollisesta sijaintikohdastaan ja niin voi alkaa gliooman kehittyminen. TLX:n ektooppinen esiintyminen U87MG-glioomasoluissa aiheuttaa solujen proliferoitumista, kolonisoitumista ja tuumorin muodostusta in vivo.
Neuroblastoomasolulinjoissa TLX säätelee angiogeneesiä vuorovaikuttamalla VHL proteiinin kanssa siihen suoraan sitoutumalla, mikä stabiloi TLX:n.
Normaaleissa hapetusolosuhteissa TLX sitoutuu ja vetäytyy erilleen VHLproteiinin kanssa stabiloiden HIF-alfan.
Mutta hypoxisissa olosuhteissa TLX lisää ilmenemistään ja sitoutuu HIF2- alfa:lle vastaavaan elementtiin VEGF-promoottorikromatiinissa ja siten yhdessä HIF2-alfan kanssa rekrytoi RNApolII indusoiden VEGF-kasvutekijän transkription.
Kts. VEGF Vascular Endothelial Growth Factor - funktio: https://www.youtube.com/watch?v=zE4BkAw_lL4
TLX näyttää olevan yksi niistä komponenteistä jotka ovat säätelemässä sekä normaalia kehitystä että patologisia prosesseja.
Väitöskirjan kirjoittana on sitä mieltä, että tarvitaan edelleen yksityiskohtaisia tieteellisiä tutkimuksia jotta saadaan käsitystä niistä mekanismeista, joita TLX käyttää.
KR Sainin väitöskirjatyön Osa I ja Osa II käsittelee enemmän TLR säätelyä.
Osa I: on julkaistu vuonna 2011:
Chavali PL, Saini RK et al. . Nuclearorphan receptor TLX induces Oct-3/4 for survival and maintenance of adult hippocampal progenitors upon hypoxia. J Biol Chem,
286:9393-9404.
Osa II
Chavali PL, Saini RK et al. TLX regulates neuroblastoma proliferation, self-renewal, migration, invasion, and MMP-2/9 levels, and elevated expression correlates with shorter patient survival. Cell Death et Dis. in press.
MikroRNA neuraalisessa kantasolussa
http://journal.frontiersin.org/Journal/10.3389/fnins.2012.00030/full
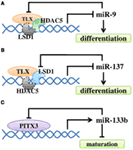 Figure 4. The regulatory loop between miRNAs and their regulators in NSC differentiation and neuronal maturation. (A)
Negative feedback regulatory loop of miR-9 and TLX. TLX recruits HDAC5
to the miR-9 locus to inhibit miR-9 expression. MiR-9 can repress the
level of TLX through its 3′ UTR. At the same time, LSD1 may be
recruited. (B) TLX recruits LSD1 to the miR-137 locus
to inhibit miR-137 expression. The expression of miR-137 can repress the
level of LSD1. Similarly, HDAC5 may be recruited. (C) Transcription factor Pitx3 promotes miR-133b expression, while miR-133b can down-regulate Pitx3 level.
Figure 4. The regulatory loop between miRNAs and their regulators in NSC differentiation and neuronal maturation. (A)
Negative feedback regulatory loop of miR-9 and TLX. TLX recruits HDAC5
to the miR-9 locus to inhibit miR-9 expression. MiR-9 can repress the
level of TLX through its 3′ UTR. At the same time, LSD1 may be
recruited. (B) TLX recruits LSD1 to the miR-137 locus
to inhibit miR-137 expression. The expression of miR-137 can repress the
level of LSD1. Similarly, HDAC5 may be recruited. (C) Transcription factor Pitx3 promotes miR-133b expression, while miR-133b can down-regulate Pitx3 level.
Front. Neurosci., 12 March 2012 | doi: 10.3389/fnins.2012.00030
MicroRNAs in neural stem cells and neurogenesis
Hironori Kawahara1,2,
Takao Imai1 and Hideyuki Okano1*
- 1 Department of Physiology, Keio University School of Medicine, Shinjuku, Tokyo, Japan
- 2 Department of Cell and Developmental Biology, University of Pennsylvania School of Medicine, Philadelphia, PA, USA
 Figure 4. The regulatory loop between miRNAs and their regulators in NSC differentiation and neuronal maturation. (A)
Negative feedback regulatory loop of miR-9 and TLX. TLX recruits HDAC5
to the miR-9 locus to inhibit miR-9 expression. MiR-9 can repress the
level of TLX through its 3′ UTR. At the same time, LSD1 may be
recruited. (B) TLX recruits LSD1 to the miR-137 locus
to inhibit miR-137 expression. The expression of miR-137 can repress the
level of LSD1. Similarly, HDAC5 may be recruited. (C) Transcription factor Pitx3 promotes miR-133b expression, while miR-133b can down-regulate Pitx3 level.
Figure 4. The regulatory loop between miRNAs and their regulators in NSC differentiation and neuronal maturation. (A)
Negative feedback regulatory loop of miR-9 and TLX. TLX recruits HDAC5
to the miR-9 locus to inhibit miR-9 expression. MiR-9 can repress the
level of TLX through its 3′ UTR. At the same time, LSD1 may be
recruited. (B) TLX recruits LSD1 to the miR-137 locus
to inhibit miR-137 expression. The expression of miR-137 can repress the
level of LSD1. Similarly, HDAC5 may be recruited. (C) Transcription factor Pitx3 promotes miR-133b expression, while miR-133b can down-regulate Pitx3 level.TLX, orpo tumareseptori säätelee neuroblastooman proliferaatiota . Mitä muuta?
LÄHDE: KR Ravi (2014) Neural Stem Cells, TLX and neuroblastoma.
ISBN 978-91-628-9091-9- Mikä on tämä tumareeptori TLX? Sen synonyymi on NR2E1
- Tietoa vuodelta 2011:
Drosophila Tailless (Tll) ja sen selkärankaisissa esiintyvä homologi TLX.
Se on konservoitunut orpotumaresepotori jota ilmeneee erityisesti silmässä ja etuaivossa.
Tll ja TLX toimivat ensisijaisesti transkription vaimentajina vuorovaikutuksillaan transkription muihin vaimentajiin, Atrofiiniperheen proteiineihin ja histonipäätteitä/kromatiinia muokkaaviin tekijöihin kuten lysiinispesifiseen histonidemetylaasi-1 entsyymiin ja histonideasetylaaseihin(HDAC).
Tll ja Tlx reseptoreiden funktionaalinen tärkeys on oivallettu viime vuosina siitä, että niitä ilmenee neuraalisissa kantasoluissa (NSC) ja solu tarvitsee niitä omaan uudistumiseensa sekä hedelmäkärpäsessä että hiiressä. Otsikon artikkelissa annetaan nopea katsaus Tll ja Tlx reseptoreista, niiden transkriptionaalisesta verkostosta, joka ylläpitää neuraalisia kantasoluja kehityksen aikaisessa ja täysikäisessä eläimessä
LÄHDE: Dev Neurosci. 2011;33(1):1-13. doi: 10.1159/000321585. Epub 2010 Dec 2. A tale of tailless.
Drosophila Tailless(Tll) and its vertebrate homologue Tlx are conserved orphan nuclear receptors specifically expressed in the eye and the forebrain. Tll and Tlx
act primarily as transcriptional repressors through their interactions
with transcriptional corepressors, Atrophin family proteins, and
histone-tail/chromatin-modifying factors such as lysine-specific histone
demethylase 1 and histone deacetylases. The functional importance of
Tll and Tlx is
made apparent by the recent discovery that they are expressed in neural
stem cells (NSCs) and are required for self-renewal of these cells in
both Drosophila and the mouse. This review provides a snapshot of
current knowledge about Tll and Tlx and their transcriptional network, which maintains NSCs in developing and adult animals.
2010 S. Karger AG, Basel.
2010 S. Karger AG, Basel.
- Artikkeleita vuodelta 2014
PubMed hakulaite antaa 68 lähdettä ja katson niistä tuoreimmat. Results: 1 to 20 of 68
1.
Xie Q, Flavahan WA, Bao S, Rich J.
Cell Stem Cell. 2014 Aug 7;15(2):114-6. doi: 10.1016/j.stem.2014.07.004.
Targeting self-renewal in high-grade brain tumors leads to loss of brain tumor stem cells and prolonged survival. [Cell Stem Cell. 2014]
In this issue of
Cell Stem Cell, Zhu et al. (2014) demonstrate that a genetically
engineered glioma model displays a functional cellular hierarchy defined
by expression of the nuclear orphan receptor Tlx. Targeting cancer stem cells through genetic deletion of TLX promotes cancer stem cell death and differentiation and extends survival.
Comment on
Comment on
2.
Benod
C, Villagomez R, Filgueira CS, Hwang PK, Leonard PG, Poncet-Montange G,
Rajagopalan S, Fletterick RJ, Gustafsson JÅ, Webb P.
PLoS One. 2014 Jun 17;9(6):e99440. doi: 10.1371/journal.pone.0099440. eCollection 2014.
Nuclear receptors (NRs) are an important group of ligand-dependent transcriptional factors. Presently, no natural or synthetic ligand has been identified for a large group of orphan NRs. Small molecules to target these orphan NRs will provide unique resources for uncovering regulatory systems that impact human health and to modulate these pathways with drugs. The orphan NR tailless (TLX, NR2E1), a transcriptional repressor, is a major player in neurogenesis and Neural Stem Cell (NSC) derived brain tumors. No chemical probes that modulate TLX activity are available, and it is not clear whether TLX is druggable. To assess TLX ligand binding capacity, we created homology models of the TLX ligand binding domain (LBD). Results suggest that TLX belongs to an emerging class of NRs that lack LBD helices α1 and α2 and that it has potential to form a large open ligand binding pocket (LBP). Using a medium throughput screening strategy, we investigated direct binding of 20,000 compounds to purified human TLX protein and verified interactions with a secondary (orthogonal) assay. We then assessed effects of verified binders on TLX activity using luciferase assays. As a result, we report identification of three compounds (ccrp1, ccrp2 and ccrp3) that bind to recombinant TLX protein with affinities in the high nanomolar to low micromolar range and enhance TLX transcriptional repressive activity. We conclude that TLX is druggable and propose that our lead compounds could serve as scaffolds to derive more potent ligands. While our ligands potentiate TLX repressive activity, the question of whether it is possible to develop ligands to de-repress TLX activity remains open.
Nuclear receptors (NRs) are an important group of ligand-dependent transcriptional factors. Presently, no natural or synthetic ligand has been identified for a large group of orphan NRs. Small molecules to target these orphan NRs will provide unique resources for uncovering regulatory systems that impact human health and to modulate these pathways with drugs. The orphan NR tailless (TLX, NR2E1), a transcriptional repressor, is a major player in neurogenesis and Neural Stem Cell (NSC) derived brain tumors. No chemical probes that modulate TLX activity are available, and it is not clear whether TLX is druggable. To assess TLX ligand binding capacity, we created homology models of the TLX ligand binding domain (LBD). Results suggest that TLX belongs to an emerging class of NRs that lack LBD helices α1 and α2 and that it has potential to form a large open ligand binding pocket (LBP). Using a medium throughput screening strategy, we investigated direct binding of 20,000 compounds to purified human TLX protein and verified interactions with a secondary (orthogonal) assay. We then assessed effects of verified binders on TLX activity using luciferase assays. As a result, we report identification of three compounds (ccrp1, ccrp2 and ccrp3) that bind to recombinant TLX protein with affinities in the high nanomolar to low micromolar range and enhance TLX transcriptional repressive activity. We conclude that TLX is druggable and propose that our lead compounds could serve as scaffolds to derive more potent ligands. While our ligands potentiate TLX repressive activity, the question of whether it is possible to develop ligands to de-repress TLX activity remains open.
Islam MM, Zhang CL.
Biochim Biophys Acta. 2014 Jun 13. pii: S1874-9399(14)00153-9. doi: 10.1016/j.bbagrm.2014.06.001. [Epub ahead of print] Review.
The orphan nuclear receptor TLX, also known as NR2E1, is an essential regulator of neural stem cell (NSC) self-renewal, maintenance, and neurogenesis. In vertebrates, TLX is specifically localized to the neurogenic regions of the forebrain and retina throughout development and adulthood. TLX regulates the expression of genes involved in multiple pathways, such as the cell cycle, DNA replication, and cell adhesion. These roles are primarily performed through the transcriptional repression or activation of downstream target genes. Emerging evidence suggests that the misregulation of TLX might play a role in the onset and progression of human neurological disorders making this factor an ideal therapeutic target. Here, we review the current understanding of TLX function, expression, regulation, and activity significant to NSC maintenance, adult neurogenesis, and brain plasticity. This article is part of a Special Issue entitled: Nuclear receptors in animal development.
The orphan nuclear receptor TLX, also known as NR2E1, is an essential regulator of neural stem cell (NSC) self-renewal, maintenance, and neurogenesis. In vertebrates, TLX is specifically localized to the neurogenic regions of the forebrain and retina throughout development and adulthood. TLX regulates the expression of genes involved in multiple pathways, such as the cell cycle, DNA replication, and cell adhesion. These roles are primarily performed through the transcriptional repression or activation of downstream target genes. Emerging evidence suggests that the misregulation of TLX might play a role in the onset and progression of human neurological disorders making this factor an ideal therapeutic target. Here, we review the current understanding of TLX function, expression, regulation, and activity significant to NSC maintenance, adult neurogenesis, and brain plasticity. This article is part of a Special Issue entitled: Nuclear receptors in animal development.
4.
Murai K, Qu Q, Sun G, Ye P, Li W, Asuelime G, Sun E, Tsai GE, Shi Y.
Proc Natl Acad Sci U S A. 2014 Jun 24;111(25):9115-20. doi: 10.1073/pnas.1406779111. Epub 2014 Jun 10.
The role of the nuclear receptor TLX in hippocampal neurogenesis and cognition has just begun to be explored. In this study, we generated a transgenic mouse model that expresses TLX under the control of the promoter of nestin, a neural precursor marker. Transgenic TLX expression led to mice with enlarged brains with an elongated hippocampal dentate gyrus and increased numbers of newborn neurons. Specific expression of TLX in adult hippocampal dentate gyrus via lentiviral transduction increased the numbers of BrdU(+) cells and BrdU(+)NeuN(+) neurons. Furthermore, the neural precursor-specific expression of the TLX transgene substantially rescued the neurogenic defects of TLX-null mice. Consistent with increased neurogenesis in the hippocampus, the TLX transgenic mice exhibited enhanced cognition with increased learning and memory. These results suggest a strong association between hippocampal neurogenesis and cognition, as well as significant contributions of TLX to hippocampal neurogenesis, learning, and memory.
The role of the nuclear receptor TLX in hippocampal neurogenesis and cognition has just begun to be explored. In this study, we generated a transgenic mouse model that expresses TLX under the control of the promoter of nestin, a neural precursor marker. Transgenic TLX expression led to mice with enlarged brains with an elongated hippocampal dentate gyrus and increased numbers of newborn neurons. Specific expression of TLX in adult hippocampal dentate gyrus via lentiviral transduction increased the numbers of BrdU(+) cells and BrdU(+)NeuN(+) neurons. Furthermore, the neural precursor-specific expression of the TLX transgene substantially rescued the neurogenic defects of TLX-null mice. Consistent with increased neurogenesis in the hippocampus, the TLX transgenic mice exhibited enhanced cognition with increased learning and memory. These results suggest a strong association between hippocampal neurogenesis and cognition, as well as significant contributions of TLX to hippocampal neurogenesis, learning, and memory.
5.
Hu Y, Luo M, Ni N, Den Y, Xia J, Chen J, Ji J, Zhou X, Fan X, Gu P.
Stem Cells Dev. 2014 Jul 14. [Epub ahead of print]
Recent research has demonstrated critical roles of a number of microRNAs (miRNAs) in stem cell proliferation and differentiation. miRNA-9 (miR-9) is a brain-enriched miRNA. Whether miR-9 has a role in retinal progenitor cell (RPC) proliferation and differentiation remains unknown. In this study, we show that miR-9 plays an important role in RPC fate determination. The expression of miR-9 was inversely correlated with that of the nuclear receptor TLX, which is an essential regulator of neural stem cell self-renewal. Overexpression of miR-9 downregulated the TLX levels in RPCs, leading to reduced RPC proliferation and increased neuronal and glial differentiation, and the effect of miR-9 overexpression on RPC proliferation and differentiation was inhibited by the TLX overexpression; knockdown of miR-9 resulted in increased TLX expression as well as enhanced proliferation of RPCs. Furthermore, inhibition of endogenous TLX by small interfering RNA suppressed RPC proliferation and promoted RPCs to differentiate into retinal neuronal and glial cells. These results suggest that miR-9 and TLX form a feedback regulatory loop to coordinate the proliferation and differentiation of retinal progenitors.
Recent research has demonstrated critical roles of a number of microRNAs (miRNAs) in stem cell proliferation and differentiation. miRNA-9 (miR-9) is a brain-enriched miRNA. Whether miR-9 has a role in retinal progenitor cell (RPC) proliferation and differentiation remains unknown. In this study, we show that miR-9 plays an important role in RPC fate determination. The expression of miR-9 was inversely correlated with that of the nuclear receptor TLX, which is an essential regulator of neural stem cell self-renewal. Overexpression of miR-9 downregulated the TLX levels in RPCs, leading to reduced RPC proliferation and increased neuronal and glial differentiation, and the effect of miR-9 overexpression on RPC proliferation and differentiation was inhibited by the TLX overexpression; knockdown of miR-9 resulted in increased TLX expression as well as enhanced proliferation of RPCs. Furthermore, inhibition of endogenous TLX by small interfering RNA suppressed RPC proliferation and promoted RPCs to differentiate into retinal neuronal and glial cells. These results suggest that miR-9 and TLX form a feedback regulatory loop to coordinate the proliferation and differentiation of retinal progenitors.
6.
Zhu
Z, Khan MA, Weiler M, Blaes J, Jestaedt L, Geibert M, Zou P, Gronych J,
Bernhardt O, Korshunov A, Bugner V, Lichter P, Radlwimmer B, Heiland S,
Bendszus M, Wick W, Liu HK.
Cell Stem Cell. 2014 Aug 7;15(2):185-98. doi: 10.1016/j.stem.2014.04.007. Epub 2014 May 15.
Cancer stem cells (CSCs) have been suggested as potential therapeutic targets for treating malignant tumors, but the in vivo supporting evidence is still missing. Using a GFP reporter driven by the promoter of the nuclear receptor tailless (Tlx), we demonstrate that Tlx(+) cells in primary brain tumors are mostly quiescent. Lineage tracing demonstrates that single Tlx(+) cells can self-renew and generate Tlx(-) tumor cells in primary tumors, suggesting that they are brain tumor stem cells (BTSCs). After introducing a BTSC-specific knock-out of the Tlx gene in primary mouse tumors, we observed a loss of self-renewal of BTSCs and prolongation of animal survival, accompanied by induction of essential signaling pathways mediating cell-cycle arrest, cell death, and neural differentiation. Our study demonstrates the feasibility of targeting glioblastomas and indicates the suitability of BTSCs as therapeutic targets, thereby supporting the CSC hypothesis.
Cancer stem cells (CSCs) have been suggested as potential therapeutic targets for treating malignant tumors, but the in vivo supporting evidence is still missing. Using a GFP reporter driven by the promoter of the nuclear receptor tailless (Tlx), we demonstrate that Tlx(+) cells in primary brain tumors are mostly quiescent. Lineage tracing demonstrates that single Tlx(+) cells can self-renew and generate Tlx(-) tumor cells in primary tumors, suggesting that they are brain tumor stem cells (BTSCs). After introducing a BTSC-specific knock-out of the Tlx gene in primary mouse tumors, we observed a loss of self-renewal of BTSCs and prolongation of animal survival, accompanied by induction of essential signaling pathways mediating cell-cycle arrest, cell death, and neural differentiation. Our study demonstrates the feasibility of targeting glioblastomas and indicates the suitability of BTSCs as therapeutic targets, thereby supporting the CSC hypothesis.
7.
Qin S, Niu W, Iqbal N, Smith DK, Zhang CL.
Front Neurosci. 2014 Apr 10;8:74. doi: 10.3389/fnins.2014.00074. eCollection 2014.
Neural stem cells (NSCs) are self-renewing multipotent progenitors that generate both neurons and glia. The precise control of NSC behavior is fundamental to the architecture and function of the central nervous system. We previously demonstrated that the orphan nuclear receptor TLX is required for postnatal NSC activation and neurogenesis in the neurogenic niche. Here, we show that TLX modulates bone morphogenetic protein (BMP)-SMAD signaling to control the timing of postnatal astrogenesis. Genes involved in the BMP signaling pathway, such as Bmp4, Hes1, and Id3, are upregulated in postnatal brains lacking Tlx. Chromatin immunoprecipitation and electrophoretic mobility shift assays reveal that TLX can directly bind the enhancer region of Bmp4. In accordance with elevated BMP signaling, the downstream effectors SMAD1/5/8 are activated by phosphorylation in Tlx mutant mice. Consequently, Tlx mutant brains exhibit an early appearance and increased number of astrocytes with marker expression of glial fibrillary acidic protein (GFAP) and S100B. Taken together, these results suggest that TLX tightly controls postnatal astrogenesis through the modulation of BMP-SMAD signaling pathway activity.
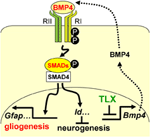 Figure 7. A schematic diagram illustrating the interplay
between TLX and the BMP-SMAD signaling pathway in the regulation of
neurogenesis and astrogenesis. TLX directly modulates the
expression of the BMP ligands, which bind and activate the type I (RI)
and type II (RII) receptors. These events result in phosphorylation of
regulatory SMADs and their dimerization with the common cofactor SMAD4.
The SMAD complex acts as a transcriptional activator to induce the
expression of downstream targets, which promote astrogenesis and inhibit
neurogenesis.
Figure 7. A schematic diagram illustrating the interplay
between TLX and the BMP-SMAD signaling pathway in the regulation of
neurogenesis and astrogenesis. TLX directly modulates the
expression of the BMP ligands, which bind and activate the type I (RI)
and type II (RII) receptors. These events result in phosphorylation of
regulatory SMADs and their dimerization with the common cofactor SMAD4.
The SMAD complex acts as a transcriptional activator to induce the
expression of downstream targets, which promote astrogenesis and inhibit
neurogenesis.
Neural stem cells (NSCs) are self-renewing multipotent progenitors that generate both neurons and glia. The precise control of NSC behavior is fundamental to the architecture and function of the central nervous system. We previously demonstrated that the orphan nuclear receptor TLX is required for postnatal NSC activation and neurogenesis in the neurogenic niche. Here, we show that TLX modulates bone morphogenetic protein (BMP)-SMAD signaling to control the timing of postnatal astrogenesis. Genes involved in the BMP signaling pathway, such as Bmp4, Hes1, and Id3, are upregulated in postnatal brains lacking Tlx. Chromatin immunoprecipitation and electrophoretic mobility shift assays reveal that TLX can directly bind the enhancer region of Bmp4. In accordance with elevated BMP signaling, the downstream effectors SMAD1/5/8 are activated by phosphorylation in Tlx mutant mice. Consequently, Tlx mutant brains exhibit an early appearance and increased number of astrocytes with marker expression of glial fibrillary acidic protein (GFAP) and S100B. Taken together, these results suggest that TLX tightly controls postnatal astrogenesis through the modulation of BMP-SMAD signaling pathway activity.
FIGURE 7
 Figure 7. A schematic diagram illustrating the interplay
between TLX and the BMP-SMAD signaling pathway in the regulation of
neurogenesis and astrogenesis. TLX directly modulates the
expression of the BMP ligands, which bind and activate the type I (RI)
and type II (RII) receptors. These events result in phosphorylation of
regulatory SMADs and their dimerization with the common cofactor SMAD4.
The SMAD complex acts as a transcriptional activator to induce the
expression of downstream targets, which promote astrogenesis and inhibit
neurogenesis.
Figure 7. A schematic diagram illustrating the interplay
between TLX and the BMP-SMAD signaling pathway in the regulation of
neurogenesis and astrogenesis. TLX directly modulates the
expression of the BMP ligands, which bind and activate the type I (RI)
and type II (RII) receptors. These events result in phosphorylation of
regulatory SMADs and their dimerization with the common cofactor SMAD4.
The SMAD complex acts as a transcriptional activator to induce the
expression of downstream targets, which promote astrogenesis and inhibit
neurogenesis.
8.
Xia J, Luo M, Ni N, Chen J, Hu Y, Deng Y, Ji J, Zhou J, Fan X, Gu P.
PLoS One. 2013 Sep 30;8(9):e76157. doi: 10.1371/journal.pone.0076157. eCollection 2013.
- Artikkeleita vuodelta 2013
9.
Chan CM, Fulton J, Montiel-Duarte C, Collins HM, Bharti N, Wadelin FR, Moran PM, Mongan NP, Heery DM.
Nucleic Acids Res. 2013 Nov;41(21):9663-79. doi: 10.1093/nar/gkt761. Epub 2013 Aug 23.
10.
Juárez P, Valdovinos MG, May ME, Lloyd BP, Couppis MH, Kennedy CH.
Behav Brain Res. 2013 Nov 1;256:354-61. doi: 10.1016/j.bbr.2013.07.044. Epub 2013 Aug 6.
11.
Ben Abdallah NM, Filipkowski RK, Pruschy M, Jaholkowski P, Winkler J, Kaczmarek L, Lipp HP.
Behav Brain Res. 2013 Sep 1;252:275-86. doi: 10.1016/j.bbr.2013.05.034. Epub 2013 May 25.
12.
Ryan SM, O'Keeffe GW, O'Connor C, Keeshan K, Nolan YM.
Brain Behav Immun. 2013 Oct;33:7-13. doi: 10.1016/j.bbi.2013.03.005. Epub 2013 Mar 16.
13.
Wang Y, Liu HK, Schütz G.
Mech Dev. 2013 Jun-Aug;130(6-8):388-90. doi: 10.1016/j.mod.2013.02.001. Epub 2013 Feb 13. Review.
Tailless (Tlx) is an orphan nuclear receptor
which is specifically expressed in the neural stem cells of the two
largest germinal neurogenesis zones in the adult mouse brain, the
subventricular zone (SVZ) of the lateral ventricle and the subgranular
zone (SGZ) of the dentate gyrus. By interacting with its cofactors, Tlx
represses its target genes and plays an important role in the
maintenance of adult NSCs. This review provides a snapshot of current
knowledge about Tlx function in adult NSCs.
14.
Zeng ZJ, Johansson E, Hayashi A, Chavali PL, Akrap N, Yoshida T, Kohno K, Izumi H, Funa K.
Biol Open. 2012 Jun 15;1(6):527-35. doi: 10.1242/bio.2012893. Epub 2012 Apr 18.
TLX is known as the orphan nuclear receptor
indispensable for maintaining neural stem cells in adult neurogenesis.
We report here that neuroblastoma cell lines express high levels of TLX, which further increase in hypoxia to enhance the angiogenic capacity of these cells. The proangiogenetic activity of TLX appears to be induced by its direct binding to the von Hippel-Lindau protein (pVHL), which stabilizes TLX. In turn, TLX
competes with hydroxylated hypoxia-inducible factor (HIF-α) for binding
to pVHL, which contributes to the stabilization of HIF-2α in
neuroblastoma during normoxia. Upon hypoxia, TLX
increases in the nucleus where it binds in close proximity of the
HIF-response element on the VEGF-promoter chromatin, and, together with
HIF-2α, recruits RNA polymerase II to induce VEGF expression.
Conversely, depletion of TLX
by shRNA decreases the expression of HIF-2α and VEGF as well as the
growth-promoting and colony-forming capacity of the neuroblastoma cell
lines IMR-32 and SH-SY5Y. On the contrary, silencing HIF-2α will
slightly increase TLX, suggesting that TLX acts to maintain a hypoxic environment when HIF-2α is decreasing. Our results demonstrate TLX to play a key role in controlling angiogenesis by regulating HIF-2α. TLX
and pVHL might counterbalance each other in important fate decisions
such as self-renewal and differentiation, as well as angiogenesis and
anti-angiogenesis.
- Artikkeleita vuodelta 2012
15.
Green HF, Nolan YM.
Transl Psychiatry. 2012 Nov 20;2:e194. doi: 10.1038/tp.2012.117.
Glycogen synthase kinase-3β (GSK-3β) and the orphan nuclear receptor tailless homolog (TLX) are key regulators of hippocampal neurogenesis, which has been reported to be dysregulated in both neurodegenerative and psychiatric disorders. Inflammation is also implicated in the neuropathology of these disorders because of increased levels of the pro-inflammatory cytokine interleukin-1β (IL-1β) in the brain. At elevated levels, IL-1β signaling through the IL-1 receptor type 1 has been shown to be detrimental to hippocampal neurogenesis. TLX is required to maintain neural stem/progenitor cells (NSPCs) in an undifferentiated state and is involved in NSPC fate determination, while GSK-3β negatively regulates Wnt signaling, a vital pathway promoting neurogenesis. This study shows that GSK-3β inhibition using a small-molecule inhibitor and the mood stabilizer lithium restores the IL-1β-induced decrease in NSPC proliferation and neuronal differentiation of embryonic rat hippocampal NSPCs to control levels. The IL-1β-induced effect on NSPCs is paralleled by a decrease in TLX expression that can be prevented by GSK-3β inhibition. The present results suggest that GSK-3β ameliorates the anti-proliferative and pro-gliogenic effects of IL-1β, and that TLX is vulnerable to inflammatory insult. Strategies to reduce GSK-3β activity or to increase TLX expression may facilitate the restoration of hippocampal neurogenesis in neuroinflammatory conditions where neurogenesis is impaired.
Glycogen synthase kinase-3β (GSK-3β) and the orphan nuclear receptor tailless homolog (TLX) are key regulators of hippocampal neurogenesis, which has been reported to be dysregulated in both neurodegenerative and psychiatric disorders. Inflammation is also implicated in the neuropathology of these disorders because of increased levels of the pro-inflammatory cytokine interleukin-1β (IL-1β) in the brain. At elevated levels, IL-1β signaling through the IL-1 receptor type 1 has been shown to be detrimental to hippocampal neurogenesis. TLX is required to maintain neural stem/progenitor cells (NSPCs) in an undifferentiated state and is involved in NSPC fate determination, while GSK-3β negatively regulates Wnt signaling, a vital pathway promoting neurogenesis. This study shows that GSK-3β inhibition using a small-molecule inhibitor and the mood stabilizer lithium restores the IL-1β-induced decrease in NSPC proliferation and neuronal differentiation of embryonic rat hippocampal NSPCs to control levels. The IL-1β-induced effect on NSPCs is paralleled by a decrease in TLX expression that can be prevented by GSK-3β inhibition. The present results suggest that GSK-3β ameliorates the anti-proliferative and pro-gliogenic effects of IL-1β, and that TLX is vulnerable to inflammatory insult. Strategies to reduce GSK-3β activity or to increase TLX expression may facilitate the restoration of hippocampal neurogenesis in neuroinflammatory conditions where neurogenesis is impaired.
16.
Zou Y, Niu W, Qin S, Downes M, Burns DK, Zhang CL.
Mol Cell Biol. 2012 Dec;32(23):4811-20. doi: 10.1128/MCB.01122-12. Epub 2012 Oct 1.
Neural stem cells (NSCs) continually generate functional neurons in the
adult brain. Due to their ability to proliferate, deregulated NSCs or
their progenitors have been proposed as the cells of origin for a number
of primary central nervous system neoplasms, including infiltrating
gliomas. The orphan nuclear receptor TLX
is required for proliferation of adult NSCs, and its upregulation
promotes brain tumor formation. However, it is unknown whether TLX is required for gliomagenesis. We examined the genetic interactions between TLX and several tumor suppressors, as well as the role of TLX-dependent NSCs during gliomagenesis, using mouse models. Here, we show that TLX
is essential for the proliferation of adult NSCs with a single deletion
of p21, p53, or Pten or combined deletion of Pten and p53. While brain
tumors still form in Tlx
mutant mice, these tumors are less infiltrative and rarely associate
with the adult neurogenic niches, suggesting a non-stem-cell origin.
Taken together, these results indicate a critical role for TLX in NSC-dependent gliomagenesis and implicate TLX as a therapeutic target to inhibit the development of NSC-derived brain tumors.
17.
Li S, Sun G, Murai K, Ye P, Shi Y.
PLoS One. 2012;7(8):e43324. doi: 10.1371/journal.pone.0043324. Epub 2012 Aug 30.
18.
Weber KP, Alvaro CG, Baer GM, Reinert K, Cheng G, Clever S, Wightman B.
BMC Evol Biol. 2012 Jun 12;12:81. doi: 10.1186/1471-2148-12-81.
Estruch SB, Buzón V, Carbó LR, Schorova L, Lüders J, Estébanez-Perpiñá E.
PLoS One. 2012;7(6):e37963. doi: 10.1371/journal.pone.0037963. Epub 2012 Jun 4.
Nuclear orphan receptor TLX (NR2E1) functions primarily as a transcriptional repressor and its pivotal role in brain development, glioblastoma, mental retardation and retinopathologies make it an attractive drug target. TLX is expressed in the neural stem cells (NSCs) of the subventricular zone and the hippocampus subgranular zone, regions with persistent neurogenesis in the adult brain, and functions as an essential regulator of NSCs maintenance and self-renewal. Little is known about the TLX social network of interactors and only few TLX coregulators are described. To identify and characterize novel TLX-binders and possible coregulators, we performed yeast-two-hybrid (Y2H) screens of a human adult brain cDNA library using different TLX constructs as baits. Our screens identified multiple clones of Atrophin-1 (ATN1), a previously described TLX interactor. In addition, we identified an interaction with the oncoprotein and zinc finger transcription factor BCL11A (CTIP1/Evi9), a key player in the hematopoietic system and in major blood-related malignancies. This interaction was validated by expression and coimmunoprecipitation in human cells. BCL11A potentiated the transrepressive function of TLX in an in vitro reporter gene assay. Our work suggests that BCL11A is a novel TLX coregulator that might be involved in TLX-dependent gene regulation in the brain.
Nuclear orphan receptor TLX (NR2E1) functions primarily as a transcriptional repressor and its pivotal role in brain development, glioblastoma, mental retardation and retinopathologies make it an attractive drug target. TLX is expressed in the neural stem cells (NSCs) of the subventricular zone and the hippocampus subgranular zone, regions with persistent neurogenesis in the adult brain, and functions as an essential regulator of NSCs maintenance and self-renewal. Little is known about the TLX social network of interactors and only few TLX coregulators are described. To identify and characterize novel TLX-binders and possible coregulators, we performed yeast-two-hybrid (Y2H) screens of a human adult brain cDNA library using different TLX constructs as baits. Our screens identified multiple clones of Atrophin-1 (ATN1), a previously described TLX interactor. In addition, we identified an interaction with the oncoprotein and zinc finger transcription factor BCL11A (CTIP1/Evi9), a key player in the hematopoietic system and in major blood-related malignancies. This interaction was validated by expression and coimmunoprecipitation in human cells. BCL11A potentiated the transrepressive function of TLX in an in vitro reporter gene assay. Our work suggests that BCL11A is a novel TLX coregulator that might be involved in TLX-dependent gene regulation in the brain.
etc
Etiketter:
TLX aiheesta artikkeleita 2012-2014
Yleistietoa neuroblastoomasta
Suomen olosuhteissa
http://www.duodecimlehti.fi/web/guest/arkisto?p_p_id=Article_WAR_DL6_Articleportlet&p_p_action=1&p_p_state=maximized&p_p_mode=view&p_p_col_id=column-1&p_p_col_count=1&viewType=viewArticle&tunnus=duo10536
Lapsuusiän syövät.

http://fi.wikipedia.org/wiki/Neuroblastooma
Kuinka nopeasti lapsen syöpä diagnosoidaan?
http://duodecimlehti.fi/web/guest/arkisto?p_p_id=Article_WAR_DL6_Articleportlet&viewType=viewArticle&tunnus=duo91599&_dlehtihaku_view_article_WAR_dlehtihaku_p_auth=
http://www.duodecimlehti.fi/web/guest/arkisto?p_p_id=Article_WAR_DL6_Articleportlet&p_p_action=1&p_p_state=maximized&p_p_mode=view&p_p_col_id=column-1&p_p_col_count=1&viewType=viewArticle&tunnus=duo10536
Lapsuusiän syövät.

http://fi.wikipedia.org/wiki/Neuroblastooma
Kuinka nopeasti lapsen syöpä diagnosoidaan?
http://duodecimlehti.fi/web/guest/arkisto?p_p_id=Article_WAR_DL6_Articleportlet&viewType=viewArticle&tunnus=duo91599&_dlehtihaku_view_article_WAR_dlehtihaku_p_auth=
torsdag 9 oktober 2014
Hedgehog signaalitie
https://www.youtube.com/watch?v=XVePUTdUdTw
http://en.wikipedia.org/wiki/Hedgehog_signaling_pathway
Hedgehog signaalitie välittää asianmukaiseen kehitykseen tarvitavaa informaatiota alkion soluille.Eri osissa alkiota on erilaisia määriä Hedgehog-signaaliproteiineja. Muta tällä' signaalitiellä on merkitystä myös aikuisessa. Eräskin tauti , josa Hedgehog-signaalitie toimii vääriin, on basaalisolukarsinoma.
Hedgehog-signalointitie on eräs avainsäätelijä animaalisen kehon kehityksessä ja esiintyy kaikessa, missä on bilateriaalisuutta, kaksikylkisyyttä. Tämä tarkoittaa esim ihmisen peilikuvamaiset raajat, oikea ja vasen käsi , oikea ja vasen silmä jne.
The Hedgehog signaling (or signalling see spelling differences) pathway is a signaling pathway that transmits information to embryonic cells required for proper development. Different parts of the embryo have different concentrations of hedgehog signaling proteins. The pathway also has roles in the adult. Diseases associated with the malfunction of this pathway include basal cell carcinoma.[1]
The Hedgehog signaling pathway is one of the key regulators of animal development and is present in all bilaterians.[2]
Signaalitie saa nimensä sen polypetidiligandista, joka on solunsisäinen signaloiva molekyyli Hedgehog (Hh) . Se löydettiin banaanikärpäseltä. Hh on banaanikärpäsen segmenttipolaarisuuden geenin tuotteita , joka osallistuu kärpäsen kehotason perustan muodostamiseen. Molekyyli säilyttää tärkeytensä myös embryogeneesin loppuvaieessa ja metamorfoosissa.
The pathway takes its name from its polypeptide ligand, an intercellular signaling molecule called Hedgehog (Hh) found in fruit flies of the genus Drosophila. Hh is one of Drosophila's segment polarity gene products, involved in establishing the basis of the fly body plan. The molecule remains important during later stages of embryogenesis and metamorphosis.
Imettäväiskehoissa on kolme Hedgehog homologia DHH, IHH ja SHH. Näistä on Sonic HH, SHH parhaiten tutkittu. Tämä signaalitie on samalla tavalla tärkeä selkärankaisten alkiokehityksen aikana. Poistogeeniseen hiireen, josta puuttuu tämän signaalitien komponentit, tulee kehitysanomalioita aivoihin, luurankoon, lihaksistoon, mahasuolikanavaan ja keuhkoihin. Tuoreet tutkimukset osoittavat, että Hedgehog-signalointitie - säädellen aikuisen kantasoluja - osallistuu aikuiskudosten ylläpitoon ja regeneraatioon. Tämän signaalitien on havaittu toimivan myös joissain syövissä. Moni lääketeollinen yhtiö on kehittelemässä aktiivisti syövän vastaisia lääkkeitä, jotka spesifisesti kohdentuvat hedgehog-signalointiin.
Mammals have three Hedgehog homologues, DHH, IHH, and SHH, of which Sonic (SHH) is the best studied. The pathway is equally important during vertebrate embryonic development. In knockout mice lacking components of the pathway, the brain, skeleton, musculature, gastrointestinal tract and lungs fail to develop correctly. Recent studies point to the role of Hedgehog signaling in regulating adult stem cells involved in maintenance and regeneration of adult tissues. The pathway has also been implicated in the development of some cancers. Drugs that specifically target Hedgehog signaling to fight this disease are being actively developed by a number of pharmaceutical companies.
Sonic hedgehog eller sonic hedgehog-homolog, ibland förkortat SHH, är ett protein som finns hos däggdjur och har viktiga funktioner för organutvecklingen, såsom hjärnans utveckling eller framväxten av ben och armar. Namnet kommer från början från bananflugan, där genen och proteinet kallades hedgehog.
Sonic hedgehog, liksom besläktade proteiner hos andra djurarter, ingår i ett system för signalering mellan celler. Den verkar som en morfogen, och är även det mest välutforskade i ryggradsdjur genom diffusion från cell till cell bildas en koncentrationsgradient av molekylen, och ämnet har olika verkan på embryots celler beroende på koncentration. Proteinet sonic hedgehog har dock funktioner även hos vuxna; den kontrollerar celldelning i stamceller hos vuxna, och har visat sig påverka utvecklingen av vissa sorters cancer.
Genen hedgehog upptäcktes i Eric Wieschaus' och Christiane Nüsslein-Volhards klassiska screeningundersökningar utförda i Heidelberg, som publicerades 1978. Dessa undersökningar, som gav dem 1995 års nobelpris i medicin eller fysiologi, identifierade gener som kontrollerar hur de olika segment hos bananflugan Drosophila menalogaster utvecklas under det embryonala stadiet. Om genen muterades till en icke funktionell variant, blev embryot täckt med piggar liknande en igelkott (på engelska hedgehog, därav namnet).
Försök att hitta en homolog till hedgehog hos däggdjur avslöjade tre stycken. De två som hittades först, desert hedgehog och Indian hedgehog, namngavs efter olika igelkottsarter, medan Sonic hedgehog namngavs efter TV-spelsfiguren Sonic the Hedgehog.
http://en.wikipedia.org/wiki/Hedgehog_signaling_pathway
Hedgehog signaalitie välittää asianmukaiseen kehitykseen tarvitavaa informaatiota alkion soluille.Eri osissa alkiota on erilaisia määriä Hedgehog-signaaliproteiineja. Muta tällä' signaalitiellä on merkitystä myös aikuisessa. Eräskin tauti , josa Hedgehog-signaalitie toimii vääriin, on basaalisolukarsinoma.
Hedgehog-signalointitie on eräs avainsäätelijä animaalisen kehon kehityksessä ja esiintyy kaikessa, missä on bilateriaalisuutta, kaksikylkisyyttä. Tämä tarkoittaa esim ihmisen peilikuvamaiset raajat, oikea ja vasen käsi , oikea ja vasen silmä jne.
The Hedgehog signaling (or signalling see spelling differences) pathway is a signaling pathway that transmits information to embryonic cells required for proper development. Different parts of the embryo have different concentrations of hedgehog signaling proteins. The pathway also has roles in the adult. Diseases associated with the malfunction of this pathway include basal cell carcinoma.[1]
The Hedgehog signaling pathway is one of the key regulators of animal development and is present in all bilaterians.[2]
Signaalitie saa nimensä sen polypetidiligandista, joka on solunsisäinen signaloiva molekyyli Hedgehog (Hh) . Se löydettiin banaanikärpäseltä. Hh on banaanikärpäsen segmenttipolaarisuuden geenin tuotteita , joka osallistuu kärpäsen kehotason perustan muodostamiseen. Molekyyli säilyttää tärkeytensä myös embryogeneesin loppuvaieessa ja metamorfoosissa.
The pathway takes its name from its polypeptide ligand, an intercellular signaling molecule called Hedgehog (Hh) found in fruit flies of the genus Drosophila. Hh is one of Drosophila's segment polarity gene products, involved in establishing the basis of the fly body plan. The molecule remains important during later stages of embryogenesis and metamorphosis.
Imettäväiskehoissa on kolme Hedgehog homologia DHH, IHH ja SHH. Näistä on Sonic HH, SHH parhaiten tutkittu. Tämä signaalitie on samalla tavalla tärkeä selkärankaisten alkiokehityksen aikana. Poistogeeniseen hiireen, josta puuttuu tämän signaalitien komponentit, tulee kehitysanomalioita aivoihin, luurankoon, lihaksistoon, mahasuolikanavaan ja keuhkoihin. Tuoreet tutkimukset osoittavat, että Hedgehog-signalointitie - säädellen aikuisen kantasoluja - osallistuu aikuiskudosten ylläpitoon ja regeneraatioon. Tämän signaalitien on havaittu toimivan myös joissain syövissä. Moni lääketeollinen yhtiö on kehittelemässä aktiivisti syövän vastaisia lääkkeitä, jotka spesifisesti kohdentuvat hedgehog-signalointiin.
Mammals have three Hedgehog homologues, DHH, IHH, and SHH, of which Sonic (SHH) is the best studied. The pathway is equally important during vertebrate embryonic development. In knockout mice lacking components of the pathway, the brain, skeleton, musculature, gastrointestinal tract and lungs fail to develop correctly. Recent studies point to the role of Hedgehog signaling in regulating adult stem cells involved in maintenance and regeneration of adult tissues. The pathway has also been implicated in the development of some cancers. Drugs that specifically target Hedgehog signaling to fight this disease are being actively developed by a number of pharmaceutical companies.
- Ruotsalainen teksti kertoo, miten tämän proteiinin GEENIN löytö (1978) johti Nobelin palkintoon 1995 ja mistä Hedgehog ( siili) nimi tuli. .Nimittäin, jos Hedgehog geeni mutatoitui, banaanikärpäsen alkiosta tuli piikkinen kuten siili, eikä tapahtunut bilateralisoitumista- siis kasvu alkoi sojottaa jokasuuntaan. eikä tullut kaksikylkisyyttä.
Sonic hedgehog eller sonic hedgehog-homolog, ibland förkortat SHH, är ett protein som finns hos däggdjur och har viktiga funktioner för organutvecklingen, såsom hjärnans utveckling eller framväxten av ben och armar. Namnet kommer från början från bananflugan, där genen och proteinet kallades hedgehog.
Sonic hedgehog, liksom besläktade proteiner hos andra djurarter, ingår i ett system för signalering mellan celler. Den verkar som en morfogen, och är även det mest välutforskade i ryggradsdjur genom diffusion från cell till cell bildas en koncentrationsgradient av molekylen, och ämnet har olika verkan på embryots celler beroende på koncentration. Proteinet sonic hedgehog har dock funktioner även hos vuxna; den kontrollerar celldelning i stamceller hos vuxna, och har visat sig påverka utvecklingen av vissa sorters cancer.
Genen hedgehog upptäcktes i Eric Wieschaus' och Christiane Nüsslein-Volhards klassiska screeningundersökningar utförda i Heidelberg, som publicerades 1978. Dessa undersökningar, som gav dem 1995 års nobelpris i medicin eller fysiologi, identifierade gener som kontrollerar hur de olika segment hos bananflugan Drosophila menalogaster utvecklas under det embryonala stadiet. Om genen muterades till en icke funktionell variant, blev embryot täckt med piggar liknande en igelkott (på engelska hedgehog, därav namnet).
Försök att hitta en homolog till hedgehog hos däggdjur avslöjade tre stycken. De två som hittades först, desert hedgehog och Indian hedgehog, namngavs efter olika igelkottsarter, medan Sonic hedgehog namngavs efter TV-spelsfiguren Sonic the Hedgehog.
Etiketter:
DHH,
Hedgehog-signalointi,
IHH,
SHH
Wnt signalointitiet ja Wnt-proteiinit
https://www.ncbi.nlm.nih.gov/pubmed/28619731/
Aberrant activation of the Wnt signaling pathway plays an important role in human cancer development. Wnt signaling is negatively regulated by Axin, a scaffolding protein that controls a rate-limiting step in the destruction of β-catenin, the central activator of the Wnt pathway. In Wnt-stimulated cells, Axin is rapidly modified by tankyrase-mediated poly(ADP-ribosyl)ation, which promotes the proteolysis of Axin and consequent stabilization of β-catenin. Thus, regulation of the levels and activity of tankyrases is mechanistically important in controlling Wnt signaling. Here, we identify ubiquitin-specific protease 25 (USP25) as a positive regulator of Wnt/β-catenin signaling. We found that USP25 directly interacted with tankyrases to promote their deubiquitination and stabilization. We demonstrated that USP25 deficiency could promote the degradation of tankyrases and consequent stabilization of Axin to antagonize Wnt signaling. We further characterized the interaction between TNKS1 and USP25 by X-ray crystal structure determination. Our results provide important new insights into the molecular mechanism that regulates the turnover of tankyrases and the possibility of targeting the stability of tankyrases by antagonizing their interaction with USP25 to modulate the Wnt/β-catenin pathway.
23.10.2019 : Wnt-beta-cateniinitien säätely ubikitiini-proteosomi-järjestelmän avulla
2014
https://www.youtube.com/watch?v=YuVkRTOYOlQ
Wnt-signaalitiet ovat joukko signaalinjohtumisteitä proteiineilla, jotka johtavat solun ulkopuolelta signaalin soluseinän läpi pintareseptorin avulla solun sisälle. On olemassa kolme Wnt- signaalitietä:
(1) kanoninen Wnt-tie ( johtaa geenitranskription säätelyyn)
(2) nonkanoninen (planar cell polarity) ( säätää sytoskeletonia ja vastaa solumuodosta)
(3) nonkanoninen (Wnt/Ca-tie)( säätelee solunsisäistä kalsiumia)
Kaikki kolme aktivoituvat, kun Wnt-proteiini ligandi sitoutuu Frizzled-perheen reseptoriin, joka välittää signaalin Dishevelled proteiinille solun sisään.
The Wnt signaling pathways are a group of signal transduction pathways made of proteins that pass signals from outside of a cell through cell surface receptors to the inside of the cell. Three Wnt signaling pathways have been characterized: the canonical Wnt pathway, the noncanonical planar cell polarity pathway, and the noncanonical Wnt/calcium pathway. All three Wnt signaling pathways are activated by the binding of a Wnt-protein ligand to a Frizzled family receptor, which passes the biological signal to the protein Dishevelled inside the cell. The canonical Wnt pathway leads to regulation of gene transcription, the noncanonical planar cell polarity pathway regulates the cytoskeleton that is responsible for the shape of the cell, and the noncanonical Wnt/calcium pathway regulates calcium inside the cell.
Wnt-signaalitiet käyttävät läh solu-solu-kommunikaatiota ( parakriinista) tai samansolun kommunikaatiota ( autokriinista). Ne ovat mitä suurimmassa määrin evolutionaalisesti konservoituneita järjestelmiä, mikä tarkoittaa, että ne ovat samanlaisia eri lajeilla hedelmäkärpäsestä ihmiseen.
Wnt signaling pathways use either nearby cell-cell communication (paracrine) or same-cell communication (autocrine). They are highly evolutionarily conserved, which means they are similar across many species from fruit flies to humans.[1][2]
Wnt-signalointi keksittiin ensi kerran sen osuudesta syövän syntymiseen, mutta sittemmin se on tunnistettu myös alkioajan kehityksestä. Alkioajan prosesseissa se kontrolloi kehoakselimallin muodostumista, solun erikoistumiskohtaloita, solun proliferoitumista ja solujen migroitumista. Tällaiset prosessit ovat tärkeitä kudosten asianmukaiselle muodostumiselle, kuten esim luuston, sydämen ja lihasten muodostumisille. Wnt-tien rooli alkioajan kehityksessä keksittiin, kun Wnt-tien proteiinien mutaatioista tuottui epänormaaleja hedelmäkärpäsalkioita. Myöhemmin tutkijat havaitsivat, että epänormaaliuksen taustalla olleet geenit vaikuttivat myös rintasyövän kehittymistä hiirellä. Wnt- järjestelmän kliininen tärkeys selveni mutaatiotutkimuksilla, joissa aiheutui useita tauteja, mm. rintasyöpää, prostatasyöpää, glioblastomaa, Ii tyypin diabetesta ja muita tauteja.
Wnt signaling was first identified for its role in carcinogenesis, but has since been recognized for its function in embryonic development. The embryonic processes it controls include body axis patterning, cell fate specification, cell proliferation, and cell migration. These processes are necessary for proper formation of important tissues including bone, heart, and muscle. Its role in embryonic development was discovered when genetic mutations in proteins in the Wnt pathway produced abnormal fruit fly embryos. Later research found that the genes responsible for these abnormalities also influenced breast cancer development in mice.
The clinical importance of this pathway has been demonstrated by mutations that lead to a variety of diseases, including breast and prostate cancer, glioblastoma, type II diabetes, and others.[3][4]
Wnt- proteiinit ovat sekalainen perhe erittyneitä lipidillä modifioituneita signaloivia glykoproteiineja, joissa on 350- 400 aminohapon ketju. Näissä proteiineissa oleva lipidimodifikaatio on tyypiltääm cysteiinien palmitylaatioita. konservoituneesti 23-24 cysteinyylissä. Palmitylaatio on tärkeä seikka, koska se alkaa Wnt-proteiinin kohdentamisen plasmakalvoon erittymistä varten ja sallii Wnt- proteiinin sitoutua reseptoriinsa rasvahappojen kovalentilla liitoksella. Wnt-proteiinit käyvät läpi myös glykosylation, jossa liittyy hiilihydraattia varmistamaan asianmukaisen erittymisen. Wnt- signaloinnissa tämä proteiinit toimivat ligandeina aktivoiden erilaisia Wnt- teitä para-tai autokriinisesti. Kuten edellä mainittu, nämä proteiinitkin voat hyvin konservoituneita kauta eri lajien. niitä siis on hiirissä, ihmisissä, Xenobus, Zebrafish, Drosophila ym lajeissa.
The Wnt proteins are a diverse family of secreted lipid-modified signaling glycoproteins that are 350–400 amino acids in length.[7] The type of lipid modification that occurs on these proteins is palmitoylation of cysteines in a conserved pattern of 23–24 cysteine residues.[3] Palmitoylation is necessary because it initiates targeting of the Wnt protein to the plasma membrane for secretion and it allows the Wnt protein to bind its receptor due to the covalent attachment of fatty acids. Wnt proteins also undergo glycosylation, which attaches a carbohydrate in order to insure proper secretion.[8] In Wnt signaling, these proteins act as ligands to activate the different Wnt pathways via paracrine and autocrine routes.[1][4]
These proteins are also highly conserved across species.[2] They can be found in mice, humans, Xenopus, Zebrafish, Drosophila, and many others.[9]
Perustavaa tietoa Wnt- signaloinnista
Wnt-signalointi alkaa, kun yksi Wnt- proteiini sitoutuu Fz- perheen reseptorin N- terminaaliseen ja solun ulkopuolella olevaan cysteiinipitoiseen domaaniin. Nämä Fz- reseptorit kelluvat plasmakalvossa seitsemällä kalvonläpi kulkevalla jaksollaan ja ne muodostavat erillisperheen G-proteiiniin kytkeytyneitten reseptorien joukossa (GPCR:t): Kuitenkin tarvittaneen myös muita samanaikaisreseptoreita kiihdyttämään Wnt-signalointia Wnt-proteiini- Fz-reseptori-interaktion ohella. Esimerkiksi LRP-5/6, RTK. ROR2.
Kun reseptori aktivoituu, lähettyy signaali Dsh- fosfoproteiinille, jota on sytoplasmassa. Tämä signaali välittyy suorasta interaktiosta Fz- ja Dsh kesken. Näitä Dishevelled - proteiineja on kaikissa organismeissa ja niillä kaikilla on hyvin konservoitunut proteiinidomaaninsa: aminoterminaalinen DIX- domaani, keskinen PDZ- domaani ja karboksyterminaalinen DEP- domaani. Nämä eri domaanit ovat tärkeitä, koska Dsh:n jälkeen Wnt-signaali haaroittuu eri teiksi ja jokainen tie tekee erilaiset interaktiot näiden domaanien kanssa.
(1) kanoninen Wnt-tie ( johtaa geenitranskription säätelyyn)
(2) nonkanoninen (planar cell polarity) ( säätää sytoskeletonia ja vastaa solumuodosta)
(3) nonkanoninen (Wnt/Ca-tie)( säätelee solunsisäistä kalsiumia)
9.10.2014
Aberrant activation of the Wnt signaling pathway plays an important role in human cancer development. Wnt signaling is negatively regulated by Axin, a scaffolding protein that controls a rate-limiting step in the destruction of β-catenin, the central activator of the Wnt pathway. In Wnt-stimulated cells, Axin is rapidly modified by tankyrase-mediated poly(ADP-ribosyl)ation, which promotes the proteolysis of Axin and consequent stabilization of β-catenin. Thus, regulation of the levels and activity of tankyrases is mechanistically important in controlling Wnt signaling. Here, we identify ubiquitin-specific protease 25 (USP25) as a positive regulator of Wnt/β-catenin signaling. We found that USP25 directly interacted with tankyrases to promote their deubiquitination and stabilization. We demonstrated that USP25 deficiency could promote the degradation of tankyrases and consequent stabilization of Axin to antagonize Wnt signaling. We further characterized the interaction between TNKS1 and USP25 by X-ray crystal structure determination. Our results provide important new insights into the molecular mechanism that regulates the turnover of tankyrases and the possibility of targeting the stability of tankyrases by antagonizing their interaction with USP25 to modulate the Wnt/β-catenin pathway.
23.10.2019 : Wnt-beta-cateniinitien säätely ubikitiini-proteosomi-järjestelmän avulla
Angers S, Thorpe CJ, Biechele TL, Goldenberg SJ, Zheng N, MacCoss MJ, Moon RT.
Nat Cell Biol. 2006 Apr;8(4):348-57. Epub 2006 Mar 19.
- PMID:
- 16547521
2014
https://www.youtube.com/watch?v=YuVkRTOYOlQ
Wnt-signaalitiet ovat joukko signaalinjohtumisteitä proteiineilla, jotka johtavat solun ulkopuolelta signaalin soluseinän läpi pintareseptorin avulla solun sisälle. On olemassa kolme Wnt- signaalitietä:
(1) kanoninen Wnt-tie ( johtaa geenitranskription säätelyyn)
(2) nonkanoninen (planar cell polarity) ( säätää sytoskeletonia ja vastaa solumuodosta)
(3) nonkanoninen (Wnt/Ca-tie)( säätelee solunsisäistä kalsiumia)
Kaikki kolme aktivoituvat, kun Wnt-proteiini ligandi sitoutuu Frizzled-perheen reseptoriin, joka välittää signaalin Dishevelled proteiinille solun sisään.
The Wnt signaling pathways are a group of signal transduction pathways made of proteins that pass signals from outside of a cell through cell surface receptors to the inside of the cell. Three Wnt signaling pathways have been characterized: the canonical Wnt pathway, the noncanonical planar cell polarity pathway, and the noncanonical Wnt/calcium pathway. All three Wnt signaling pathways are activated by the binding of a Wnt-protein ligand to a Frizzled family receptor, which passes the biological signal to the protein Dishevelled inside the cell. The canonical Wnt pathway leads to regulation of gene transcription, the noncanonical planar cell polarity pathway regulates the cytoskeleton that is responsible for the shape of the cell, and the noncanonical Wnt/calcium pathway regulates calcium inside the cell.
Wnt-signaalitiet käyttävät läh solu-solu-kommunikaatiota ( parakriinista) tai samansolun kommunikaatiota ( autokriinista). Ne ovat mitä suurimmassa määrin evolutionaalisesti konservoituneita järjestelmiä, mikä tarkoittaa, että ne ovat samanlaisia eri lajeilla hedelmäkärpäsestä ihmiseen.
Wnt signaling pathways use either nearby cell-cell communication (paracrine) or same-cell communication (autocrine). They are highly evolutionarily conserved, which means they are similar across many species from fruit flies to humans.[1][2]
Wnt-signalointi keksittiin ensi kerran sen osuudesta syövän syntymiseen, mutta sittemmin se on tunnistettu myös alkioajan kehityksestä. Alkioajan prosesseissa se kontrolloi kehoakselimallin muodostumista, solun erikoistumiskohtaloita, solun proliferoitumista ja solujen migroitumista. Tällaiset prosessit ovat tärkeitä kudosten asianmukaiselle muodostumiselle, kuten esim luuston, sydämen ja lihasten muodostumisille. Wnt-tien rooli alkioajan kehityksessä keksittiin, kun Wnt-tien proteiinien mutaatioista tuottui epänormaaleja hedelmäkärpäsalkioita. Myöhemmin tutkijat havaitsivat, että epänormaaliuksen taustalla olleet geenit vaikuttivat myös rintasyövän kehittymistä hiirellä. Wnt- järjestelmän kliininen tärkeys selveni mutaatiotutkimuksilla, joissa aiheutui useita tauteja, mm. rintasyöpää, prostatasyöpää, glioblastomaa, Ii tyypin diabetesta ja muita tauteja.
Wnt signaling was first identified for its role in carcinogenesis, but has since been recognized for its function in embryonic development. The embryonic processes it controls include body axis patterning, cell fate specification, cell proliferation, and cell migration. These processes are necessary for proper formation of important tissues including bone, heart, and muscle. Its role in embryonic development was discovered when genetic mutations in proteins in the Wnt pathway produced abnormal fruit fly embryos. Later research found that the genes responsible for these abnormalities also influenced breast cancer development in mice.
The clinical importance of this pathway has been demonstrated by mutations that lead to a variety of diseases, including breast and prostate cancer, glioblastoma, type II diabetes, and others.[3][4]
Wnt- proteiinit ovat sekalainen perhe erittyneitä lipidillä modifioituneita signaloivia glykoproteiineja, joissa on 350- 400 aminohapon ketju. Näissä proteiineissa oleva lipidimodifikaatio on tyypiltääm cysteiinien palmitylaatioita. konservoituneesti 23-24 cysteinyylissä. Palmitylaatio on tärkeä seikka, koska se alkaa Wnt-proteiinin kohdentamisen plasmakalvoon erittymistä varten ja sallii Wnt- proteiinin sitoutua reseptoriinsa rasvahappojen kovalentilla liitoksella. Wnt-proteiinit käyvät läpi myös glykosylation, jossa liittyy hiilihydraattia varmistamaan asianmukaisen erittymisen. Wnt- signaloinnissa tämä proteiinit toimivat ligandeina aktivoiden erilaisia Wnt- teitä para-tai autokriinisesti. Kuten edellä mainittu, nämä proteiinitkin voat hyvin konservoituneita kauta eri lajien. niitä siis on hiirissä, ihmisissä, Xenobus, Zebrafish, Drosophila ym lajeissa.
The Wnt proteins are a diverse family of secreted lipid-modified signaling glycoproteins that are 350–400 amino acids in length.[7] The type of lipid modification that occurs on these proteins is palmitoylation of cysteines in a conserved pattern of 23–24 cysteine residues.[3] Palmitoylation is necessary because it initiates targeting of the Wnt protein to the plasma membrane for secretion and it allows the Wnt protein to bind its receptor due to the covalent attachment of fatty acids. Wnt proteins also undergo glycosylation, which attaches a carbohydrate in order to insure proper secretion.[8] In Wnt signaling, these proteins act as ligands to activate the different Wnt pathways via paracrine and autocrine routes.[1][4]
These proteins are also highly conserved across species.[2] They can be found in mice, humans, Xenopus, Zebrafish, Drosophila, and many others.[9]
| WIKI-Taulukosta on tähän otettu sitaatti vain ihmisen Wnt- proteiineista. Species |
Wnt proteins Wingless-type MMTV integration site family members |
|---|---|
| Homo sapiens | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt9A, Wnt9B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
Wnt-signalointi alkaa, kun yksi Wnt- proteiini sitoutuu Fz- perheen reseptorin N- terminaaliseen ja solun ulkopuolella olevaan cysteiinipitoiseen domaaniin. Nämä Fz- reseptorit kelluvat plasmakalvossa seitsemällä kalvonläpi kulkevalla jaksollaan ja ne muodostavat erillisperheen G-proteiiniin kytkeytyneitten reseptorien joukossa (GPCR:t): Kuitenkin tarvittaneen myös muita samanaikaisreseptoreita kiihdyttämään Wnt-signalointia Wnt-proteiini- Fz-reseptori-interaktion ohella. Esimerkiksi LRP-5/6, RTK. ROR2.
Kun reseptori aktivoituu, lähettyy signaali Dsh- fosfoproteiinille, jota on sytoplasmassa. Tämä signaali välittyy suorasta interaktiosta Fz- ja Dsh kesken. Näitä Dishevelled - proteiineja on kaikissa organismeissa ja niillä kaikilla on hyvin konservoitunut proteiinidomaaninsa: aminoterminaalinen DIX- domaani, keskinen PDZ- domaani ja karboksyterminaalinen DEP- domaani. Nämä eri domaanit ovat tärkeitä, koska Dsh:n jälkeen Wnt-signaali haaroittuu eri teiksi ja jokainen tie tekee erilaiset interaktiot näiden domaanien kanssa.
Foundation
Wnt signaling begins when one of the Wnt proteins binds the N-terminal extra-cellular cysteine-rich domain of a Frizzled (Fz) family receptor.[10] These receptors span the plasma membrane seven times and constitute a distinct family of G-protein coupled receptors (GPCRs).[11] However, to facilitate Wnt signaling, co-receptors may also be required alongside the interaction between the Wnt protein and Fz receptor. Examples include lipoprotein receptor-related protein (LRP)-5/6, receptor tyrosine kinase (Ryk), and ROR2.[4] Upon activation of the receptor, a signal is sent to the phosphoprotein Dishevelled (Dsh), which is located in the cytoplasm. This signal is transmitted via a direct interaction between Fz and Dsh. Dsh proteins are present in all organisms and they all share the following highly conserved protein domains: an amino-terminal DIX domain, a central PDZ domain, and a carboxy-terminal DEP domain. These different domains are important because after Dsh, the Wnt signal can branch off into several different pathways and each pathway interacts with a different combination of the three domains.[12]Kanoninen ja ei-kanoniset tiet
Ero näiden kolmen mainitun Wnt.signalointitien kesken on se, että kanoniseen tiehen osallistuu beta-kateniini, kun taas ei-kanoniset toimivat beta-kateniinista riippumatta. ( jatkokäännös saa odottaa)(1) kanoninen Wnt-tie ( johtaa geenitranskription säätelyyn)
(2) nonkanoninen (planar cell polarity) ( säätää sytoskeletonia ja vastaa solumuodosta)
(3) nonkanoninen (Wnt/Ca-tie)( säätelee solunsisäistä kalsiumia)
Canonical and noncanonical pathways
The three best characterized Wnt signaling pathways are the canonical Wnt pathway, the noncanonical planar cell polarity pathway, and the noncanonical Wnt/calcium pathway. As their names suggest, these pathways belong to one of two categories: canonical or noncanonical. The difference between the categories is that a canonical pathway involves the protein β-catenin while a noncanonical pathway operates independently of it.[10]9.10.2014
Prenumerera på:
Inlägg (Atom)